

招聘信息
2018必須關(guān)注的31個(gè)單抗藥物
來源:藥事縱橫
|
作者:派金生物
|
發(fā)布時(shí)間: 2018-01-14
|
22820 次瀏覽
|
分享到:
概述
單抗即單克隆抗體(Monoclonal antibody,Mab),自1986年第一個(gè)單抗產(chǎn)品問世以來栗恩,全球已近有80個(gè)單抗上市僻匿。截止目前單抗已經(jīng)發(fā)展到了四代收奔,第一代為鼠源單抗(momab)蝇居,第二代為人鼠嵌合型單抗(ximab)汛刻,第三代為人源化單抗(zumab)睁衰,第四代為全人源化單抗(mumab)用牲。人源化單抗的優(yōu)勢在于可以克服人抗鼠抗體反應(yīng),可避免單抗分子被免疫系統(tǒng)當(dāng)作異源蛋白而被快速清除蝴趾,提高單抗分子的生物學(xué)活性勋酿。

(圖片來自網(wǎng)絡(luò))
盡管產(chǎn)品不多,然而尚在市場活躍的四十余個(gè)單抗卻撐起全球近1000億美金的市場愿味,而且單抗的用藥市場增長速度遠(yuǎn)高于同行業(yè)的其它水平博个。優(yōu)良的療效,龐大的市場以及超高的附加值功偿,催生出大量開發(fā)單抗產(chǎn)品的公司盆佣,近年來全球單抗行業(yè)的發(fā)展速度已經(jīng)顯著加快。2017年美國和歐洲首次獲批的單抗首次達(dá)到2位數(shù)水平械荷,2018年上市的單抗有望進(jìn)一步達(dá)到新高共耍。2017年12月1日,已經(jīng)有9個(gè)單抗產(chǎn)品處在FDA/EMA的審評(píng)之中,有12個(gè)產(chǎn)品已經(jīng)拿到或即將拿到關(guān)鍵性臨床的數(shù)據(jù)痹兜,它們有望在2018年內(nèi)提交上市申請(qǐng)穆咐。除此之外,還有近20個(gè)單抗產(chǎn)品已經(jīng)處在臨床末期階段字旭,在不遠(yuǎn)的未來对湃,必定是單抗產(chǎn)品“百舸爭流”的時(shí)代。
2017歐美批準(zhǔn)的單抗回顧
截止2017年12月1日谐算,有10個(gè)單抗藥物在美國和歐洲獲得首次批準(zhǔn)熟尉,除brodalumab已經(jīng)于2016 年獲得日本批準(zhǔn)和sarilumab于2017年1月獲得加拿大批準(zhǔn)外,其它產(chǎn)品都是全球首批佳抗。這是10個(gè)單抗藥物坠街,有5個(gè)屬于免疫領(lǐng)域,4個(gè)是抗腫瘤領(lǐng)域灵科,1個(gè)是血液病領(lǐng)域墅失。

2017歐美批準(zhǔn)的單抗回顧
截止2017年12月1日谐算,有10個(gè)單抗藥物在美國和歐洲獲得首次批準(zhǔn)熟尉,除brodalumab已經(jīng)于2016 年獲得日本批準(zhǔn)和sarilumab于2017年1月獲得加拿大批準(zhǔn)外,其它產(chǎn)品都是全球首批佳抗。這是10個(gè)單抗藥物坠街,有5個(gè)屬于免疫領(lǐng)域,4個(gè)是抗腫瘤領(lǐng)域灵科,1個(gè)是血液病領(lǐng)域墅失。

Brodalumab
Brodalumab (Siliq, Lumicef, Kyntheum, AMG-827)是一種人IgG2抗體,靶點(diǎn)是白介素-17受體(IL-17RA)揭轰,可通過IL-17RA阻斷IL-17A的炎癥信號(hào)筑渴,促炎性細(xì)胞因子IL-17F和IL-17C。Brodalumab最早于2016年7 月4日在日本首次獲批少炎,商品名為Lumicef磕阱,獲批適應(yīng)癥為紅皮病型銀屑病、膿皰性銀屑病峡审、銀屑病關(guān)節(jié)炎和尋常性銀屑病情澈。2017年2月和2017年7月,Brodalumab分別又獲得美國和歐洲批準(zhǔn)拨聚,用于對(duì)系統(tǒng)性療法或光照療法(紫外線治療)不響應(yīng)的成人中重度斑塊狀銀屑病的治療瘤琐。Brodalumab的安全有效性在3項(xiàng)安慰劑對(duì)照的三期臨床試驗(yàn)中進(jìn)行了研究,AMAGINE-1(NCT01708590)丑瞧,AMAGINE-2(NCT01708603)和AMAGINE-3(NCT01708603)三項(xiàng)試驗(yàn)共納入患者4373名柑土。主要終點(diǎn)是第12周銀屑病面積與嚴(yán)重程度改善達(dá)75%以上(PASI75)和醫(yī)生靜態(tài)總體評(píng)估(sPGA)得分(0/1)比基線至少下降2分的患者比例。AMAGINE-1結(jié)果顯示绊汹,Brodalumab 210mg 達(dá)PASI75的比例為83%稽屏,140mg組為60%,而安慰劑組為3%西乖。sPGA得分達(dá)標(biāo)率同樣高于安慰劑組狐榔,分別為76%,54%和1%浴栽。AMAGINE-2和AMAGINE-3試驗(yàn)數(shù)據(jù)顯示,本品對(duì)中重度銀屑病臨床癥狀改善情況明顯優(yōu)于安慰劑組。AMAGINE-2中210mg 組PASI達(dá)標(biāo)率為86%典鸡,140mg組為67%被廓,而安慰劑組為8%,AMAGINE-3則依次為86%萝玷,69%和6%嫁乘,本品治療組sPGA達(dá)標(biāo)率同樣更高,AMAGINE-2中210mg組達(dá)標(biāo)率為79%立骄,140mg組為58%永努,安慰劑組為4%; AMAGINE-3中,則依次為80%辨埃,60%和4%散苦。
Avelumab
Avelumab (Bavencio,MSB0010718C)是一種以PD-L1為靶點(diǎn)的人IgG1單抗下风,首次批準(zhǔn)于2017年5月23日奇嗽。獲批適應(yīng)癥為成人和12歲以上兒童的轉(zhuǎn)移性默克爾細(xì)胞癌。2017年9月鹤肥,該適應(yīng)癥也在歐洲獲批永音。Avelumab的獲批是基于二期關(guān)鍵性臨床試驗(yàn)Javelin Merkel 200研究(NCT02155647) 的數(shù)據(jù),該試驗(yàn)包括兩部分冠樱,Part A患者事先經(jīng)過化療炭箭,Part B患者則使用Avelumab初次治療。在10mg/kg的劑量下颠舞,每兩周一次靜注菌司。Part A中,88名事先經(jīng)過化療的患者使用本品治療后病情得到了控制肛度,中位隨訪期為10.4個(gè)月傻唾,客觀緩解率為31.8%,其中8%完全緩解承耿,20%部分緩解冠骄。Part B中,39名使用本品首次治療的患者加袋,主要終點(diǎn)中位緩解時(shí)間的數(shù)據(jù)有望在2019年9月獲得凛辣。此前,Avelumab在歐洲和澳大利亞均獲得了默克爾細(xì)胞癌的孤兒藥地位职烧,還獲得FDA突破性療法認(rèn)定扁誓。2017年5月9日,F(xiàn)DA授予avelumab用于經(jīng)鉑化療后進(jìn)展的局部晚期或轉(zhuǎn)移性尿路上皮癌適應(yīng)癥優(yōu)先審評(píng)蚀之。除此以外蝗敢,本品用于非小細(xì)胞肺癌、腎細(xì)胞癌、卵巢癌和胃癌治療的4項(xiàng)三期臨床試驗(yàn)將在2018年達(dá)到終點(diǎn)寿谴,而且被美國和歐洲雙雙授予胃癌的孤兒藥資格锁右。
Dupilumab
Dupilumab (Dupixent,REGN668/SAR231893)是一種以IL4R為靶點(diǎn)的IgG4單抗细咽,于2017年4月28日和2017年9月28日分別獲得FDA和EMA批準(zhǔn)用于特應(yīng)性皮炎治療队趁。Dupixent的獲批是基于一項(xiàng)名為LIBERTY的特應(yīng)性皮炎研究項(xiàng)目,該項(xiàng)目包括SOLO1尘忿,SOLO2和CHRONOS三項(xiàng)臨床試驗(yàn)松摘。在SOLO1和SOLO2中,患者分別每周一次接受300mg Dupixent或安慰劑治療屡拥,或每兩周一次接受300mg Dupixent治療后乳栈,換用安慰劑治療。CHRONOS試驗(yàn)則是以安慰劑為對(duì)照研究Dupixent與皮質(zhì)類固醇聯(lián)合用藥的療效钾抛。試驗(yàn)的主要終點(diǎn)為16周時(shí)研究者整體評(píng)價(jià)法(IGA)得分(0/1)比基線下降大于2分的患者比例漏炕。結(jié)果顯示,Dupixent單藥治療16周衣夏,IGA達(dá)標(biāo)情況顯著高于安慰劑組扭享,SOLO1為37%,SOLO2為36%匙蚣。CHRONOS的試驗(yàn)結(jié)果與此相似续膳,dupilumab+皮質(zhì)類固醇聯(lián)合治療組為39%,而安慰劑組+類固醇組為12%收班。因?yàn)榀熜ё恐夭恚酒帆@得FDA的特應(yīng)性皮炎的突破性療法認(rèn)定。除特應(yīng)性皮炎之外摔桦,dupilumab還在開展哮喘和鼻息肉方面的適應(yīng)癥社付,目前處在三期臨床階段。2017年9月邻耕,賽諾菲/再生元宣布dupilumab用于無法控制的持續(xù)性哮喘的LIBERTY ASTHMA QUEST (NCT02414854)試驗(yàn)達(dá)到治療終點(diǎn)鸥咖。另外兩項(xiàng)關(guān)于鼻息肉治療的臨床試驗(yàn)(NCT02912468, NCT02898454)也將在2018年達(dá)到終點(diǎn)。更可喜的是本品還能用于嗜酸性食道炎治療兄世,目前研究處于臨床二期階段啼辣,而且還獲得了FDA的孤兒藥認(rèn)定。
Ocrelizumab
Ocrelizumab (Ocrevus)是一種人源化的IgG1單抗御滩,作用靶點(diǎn)是CD-20陽性的B細(xì)胞鸥拧。這種B細(xì)胞可通過產(chǎn)生促炎性細(xì)胞因子、分泌自身抗體和活化促炎性T細(xì)胞削解,而在髓鞘損傷和多發(fā)性硬化癥發(fā)病中發(fā)揮作用朝正。Ocrevus主要通過三種方式消滅CD20陽性B細(xì)胞:補(bǔ)體依賴的細(xì)胞毒作用和抗體依賴的細(xì)胞介導(dǎo)的細(xì)胞毒作用蒸败,以及在靶細(xì)胞上與CD20結(jié)合而使其凋亡。這種單抗在內(nèi)風(fēng)濕性關(guān)節(jié)炎(RA)和系統(tǒng)性紅斑狼瘡(SLE)上都進(jìn)行了臨床研究农想,但預(yù)期效果不理想平俩。Ocrevus于3月29日獲得FDA批準(zhǔn)用于復(fù)發(fā)緩解型的多發(fā)性硬化以及原發(fā)進(jìn)展型多發(fā)性硬化治療,此前該適應(yīng)癥獲得了FDA突破性療法認(rèn)定脉裕、快速通道和優(yōu)先審評(píng)資格。OPERAI(NCT01247324)和OPERAII(NCT01412333)兩項(xiàng)試驗(yàn)對(duì)Ocrevus治療發(fā)緩解型的多發(fā)性硬化的安全和有效性分別進(jìn)行了評(píng)估趟蛋,結(jié)果顯示Ocrevus治療組的年華復(fù)發(fā)率顯著低于β干擾素組邪船,其中OPERAI低46%,而OPERAII低57%同嚷。原發(fā)進(jìn)展型多發(fā)性硬化方面羔峭,ORATORIO試驗(yàn)的結(jié)果顯示,與安慰劑相比甫知,Ocrevus使12周(主要終點(diǎn))的臨床殘疾進(jìn)展顯著降低(32.9% vs 39.3%)缅钠。另外MRI顯示,接受Ocrevus治療的患者腦病變的總體積下降3.4%诡蜓,而安慰劑增加7.4%熬甫。
Durvalumab
Durvalumab (Imfinzi,MEDI4736)是一種人IgG1抗體蔓罚,可直接激活PD-L1以阻斷PD-L1及其受體(PD-1, CD80)間的聯(lián)系椿肩。Durvalumab設(shè)計(jì)初衷是阻斷細(xì)胞毒性效應(yīng)與PD-L1陽性免疫細(xì)胞間的作用,于2017年5月1日獲FDA加速批準(zhǔn)用于鉑化療惡化的局部晚期或轉(zhuǎn)移性尿路上皮癌豺谈。這是一個(gè)集優(yōu)先審評(píng)和突破性療法于一身的產(chǎn)品郑象,此次獲批是基于一項(xiàng)182名患者參與的1/2期臨床試驗(yàn)(NCT01693562)。以10mg/kg的劑量每二周一次靜脈注射Durvalumab茬末,連續(xù)用藥12個(gè)月厂榛,PD-L1高表達(dá)亞組的客觀緩解率為27.4%,PD-L1低表達(dá)亞組為4.1%丽惭。此外击奶,鉑化療進(jìn)展后局部晚期或無法手術(shù)治療的非小細(xì)胞肺癌(NSCLC)適應(yīng)癥NDA已進(jìn)入FDA審評(píng)階段,此前該申請(qǐng)獲得了FDA優(yōu)先審評(píng)和突破性療法認(rèn)定吐根。與此同時(shí)正歼,該適應(yīng)癥的上市許可申請(qǐng)(MAA)也獲得EMA受理,三期PACIFI臨床試驗(yàn)(NCT02125461)的數(shù)據(jù)也已一同提交到EMA拷橘。臨床結(jié)果顯示化療后進(jìn)展的NSCLC脖耽,以化療為背景添加本品治療,中位無進(jìn)展生存期為16.8月拨臂,而安慰劑只有5.6月京多。除以上兩個(gè)適應(yīng)癥外秤皿,Durvalumab治療PD-L1陽性的轉(zhuǎn)移性頭頸癌還被FDA授予快速通道資格,三期臨床試驗(yàn)EAGLE(NCT02369874)和KESTREL(NCT02551159)有望在2018年2月和3月分別達(dá)到終點(diǎn)痛慷。
Sarilumab
Sarilumab (Kevzara办溶,SAR153191,REGN88)是一種以IL-6R為靶點(diǎn)的IgG1單抗樱炬,2017年2月在加拿大首次獲批抠阴,2017年5月和2017年7月分別又獲FDA和EMA批準(zhǔn)用于對(duì)一種或多種生物制品或非生物制品疾病調(diào)節(jié)性抗風(fēng)濕藥物(DMARDs)不充分響應(yīng)或不耐受的中重度活動(dòng)性類風(fēng)濕性關(guān)節(jié)炎。Sarilumab的獲批是基于一項(xiàng)全球多中心的SARIL-RA臨床研究項(xiàng)目择绘,其包括MOBILITY (NCT01061736)粥割,TARGET (NCT01709578)和MONARCH (NCT02332590) 三項(xiàng)三期臨床試驗(yàn)。在MOBILITY和TARGET試驗(yàn)中混砸,sarilumab均與甲氨蝶呤或其他DMARD合用突妇。MOBILITY研究結(jié)果顯示,200mg sarilumab治療組24周ACR20達(dá)66%解滓,150mg組為58%赃磨,而安慰劑組僅33%。Sarilumab同樣可改善患者生理功能洼裤,200mg sarilumab治療組HAQ-DI評(píng)分下降0.58邻辉,150mg組為0.54,安慰劑組為0.30腮鞍。TARGET試驗(yàn)結(jié)果與前者相似恩沛,DMARD+200mg sarilumab治療組 ACR20達(dá)61%,150mg組為56%缕减,而安慰劑組為34%雷客。生理功能改善方面,DMARD+200mg sarilumab治療組HAQ-DI評(píng)分下降0.50桥狡,150mg組下降0.49搅裙,而安慰劑組僅0.29。MONARCH試驗(yàn)則以阿達(dá)木單抗為對(duì)照評(píng)估sarilumab的安全有效性裹芝。24周治療結(jié)果顯示部逮,使用紅細(xì)胞沉降率計(jì)算的28個(gè)關(guān)節(jié)的疾病活動(dòng)度評(píng)分(DAS28-ESR)從基線下降3.28,而阿達(dá)木單抗組則只下降2.20臀匹,該試驗(yàn)也達(dá)到主要終點(diǎn)讲幌。
Guselkumab
Guselkumab (Tremfya) 是一種人IgG1λ單抗,能夠阻滯IL-23的p19亞基挠站,從而限制炎癥響應(yīng)仙涡。IL-23是一種參與Th17細(xì)胞分化和維持的細(xì)胞因子,通過T細(xì)胞亞群生成促炎性細(xì)胞因子IL-17恃藐、IL-22和TNF眶蹈。2017年7月13日藤棕,guselkumab獲得FDA批準(zhǔn)用于適合系統(tǒng)療法(注射或口服治療)或光治療(紫外線治療)的中重度斑塊型銀屑病治療,2017年11月雹了,guselkumab再次獲得EMA批準(zhǔn)朴树,適應(yīng)癥與美國相同。Guselkumab獲批是基于三項(xiàng)臨床試驗(yàn)的結(jié)果索驰,分別為VOYAGE1(NCT02207231)榨惭,VOYAGE2(NCT02207244)和NAVIGATE(NCT02203032)俺下。其中VOYAGE1和VOYAGE2評(píng)估了Tremfya相對(duì)于安慰劑和阿達(dá)木單抗的療效和安全性死相,結(jié)果顯示,guselkumab治療16周桂对,IGA達(dá)標(biāo)率遠(yuǎn)高于安慰劑組(85.1% vs 6.9%)脆栋,另外,Tremfya治療組分別有73.3%和70.0%的患者實(shí)現(xiàn)PASI90 緩解洒擦,而阿達(dá)木單抗治療組分別為49.7%和46.8%椿争。NAVIGATE試驗(yàn)則評(píng)估了Tremfya相對(duì)于Stelara的療效和安全性,患者在0熟嫩、4周接受ustekinumab治療秦踪,16周后響應(yīng)不足的患者分別再次給予ustekinumab或guselkumab治療,主要終點(diǎn)是28周的IGA評(píng)分相比基線下降最低2分的患者比例掸茅。而結(jié)果顯示經(jīng)ustekinumab或guselkumab治療椅邓,28周IGA評(píng)分達(dá)標(biāo)率分別為14.3%和31.1%,32周時(shí)則分別為17.3%和36.3%昧狮,數(shù)據(jù)說明Tremfya在既往接受Stelara治療應(yīng)答不足的患者中仍具有顯著的療效景馁。
Inotuzumab ozogamicin
Inotuzumab ozogamicin (Besponsa,CMC-544)是一種抗CD22的人源化IgG4抗體與細(xì)胞毒類藥物卡奇霉素的偶聯(lián)物逗鸣。Besponsa于2017年6月30日在歐洲首次獲批合住,2017年8月17日再次獲得FDA批準(zhǔn),適應(yīng)癥均為成人復(fù)發(fā)性或難治性B細(xì)胞前體急性淋巴細(xì)胞白血蔡赜搿(ALL)释何。在此此前,Besponsa已經(jīng)獲得歐美雙方的孤兒藥資格注括,和FDA的ALL突破性療法認(rèn)定坯肿。Besponsa的獲批是基于一項(xiàng)名為INOVATE ALL三期臨床試驗(yàn)(NCT01564784),該試驗(yàn)以現(xiàn)有的標(biāo)準(zhǔn)療法進(jìn)行對(duì)照蝴车≌岢校患者在第1天(0.8mg/m2)、第8天(0.5mg/m2)和第15天(0.5mg/m2)分別接受三個(gè)劑量的Besponsa治療或標(biāo)準(zhǔn)化療蛹协。起始療程為21天蜜雏,此后每個(gè)療程均為28天韩烹,直達(dá)6個(gè)療程。結(jié)果顯示Besponsa組患者完全緩解率為80.7%孝摘,中位總生存期為7.7個(gè)月酿势,標(biāo)準(zhǔn)化療組完全緩解率為29.4%,中位總生存期為6.7個(gè)月妻往。
Benralizumab
Benralizumab (Fasenra互艾,MEDI-563) 是一個(gè)去巖藻糖基化的IgG1單抗,靶點(diǎn)為IL-5R的α亞基讯泣。 FDA于2017年11月14日批準(zhǔn)本品用于12 歲以上12歲及以上具有嗜酸性表型的重度哮喘 患者的附加維持治療纫普,2017年11月10日,EMA的專家委員會(huì)也對(duì)本品的上市給出積極的意見好渠。本品的安全有效性WINDWARD研究項(xiàng)目中得到評(píng)估昨稼,該項(xiàng)目包括SIROCCO,CALIMA拳锚,ZONDA假栓,BISE,BORA和GREGALE等6項(xiàng)三期臨床試驗(yàn)霍掺。其中SIROCCO(NCT01928771)和CALIMA (NCT01914757)兩項(xiàng)隨機(jī)匾荆、雙盲、平行杆烁、安慰劑控制的臨床試驗(yàn)評(píng)價(jià)了本品長期用藥安全性牙丽,患者長期以30mg的固定劑量皮下注射benralizumab長達(dá)56周,研究的結(jié)果在2016年公開兔魂。在為期28周的ZONDA(NCT02075255)試驗(yàn)中郑舷,中重度哮喘患者在口服糖皮質(zhì)激素的基礎(chǔ)上每四周或8周一次注射Benralizumab 30mg 或安慰劑對(duì)病情維持治療,結(jié)果顯示锌拱,Benralizumab組糖皮質(zhì)激素用量降低75%俭宁,而安慰劑組僅下降 25%。
Emicizumab
Emicizumab (Hemlibra陷母,emicizumab-kxwh贷营,ACE910,RO5534262) 是一種雙特異性IgG4抗體尿欲,靶點(diǎn)為IXa和X诬粗,2017年11月16日首次獲得FDA批準(zhǔn)用于預(yù)防或減少體內(nèi)含有凝血因子VIII抑制物的A型血友病患者的出血頻率。在此之前溜舷,Emicizumab已經(jīng)獲得FDA的孤兒藥和突破性療法認(rèn)定扯凫。日本和歐洲的上市許可申請(qǐng)審評(píng)中,歐洲被授予加速審評(píng)資格开摄,日本則給予孤兒藥認(rèn)定售拼。Emicizumab最早由中外發(fā)現(xiàn)且昭,與羅氏一同開發(fā)并推向全球推向市場。本品的獲批是基于HAVEN1(NCT02622321)的臨床研究結(jié)果和HAVEN2(NCT02795767)的中期結(jié)果贱鼻。HAVEN1研究表明宴卖,12歲及以上的體內(nèi)含有VIII因子抑制物的A型血友病患者在接受Hemlibra預(yù)防治療后,與沒有接受預(yù)防患者相比邻悬,年出血率顯著降低87%(2.9 vs 23.3)症昏。AVEN2研究的中期結(jié)果表明,12歲以下的體內(nèi)含有抑制物的A型血友病兒童患者父丰,在接受Hemlibra預(yù)防后肝谭,有87%未出現(xiàn)出血。在參加NIS 的13名兒童患者的患者內(nèi)分析中蛾扇,Hemlibra預(yù)防治療與接受旁路制劑治療(BPA)的患者相比出血率降低99%攘烛。
處于歐美審評(píng)中的單抗
截止2017年12月1日,一共有9個(gè)單抗產(chǎn)品在歐美的審評(píng)中镀首,除 mogamulizumab于2012年已經(jīng)在日本獲批外坟漱,ibalizumab,burosumab蘑斧,tildrakizumab,caplacizumab卢操,erenumab堡喳,fremanezumab,galcanezumab企奔,romosozumab 尚未在任何國家批準(zhǔn)祸播。這些產(chǎn)品有望在2018年問世,其中burosumab和ibalizumab有望在1月或2月獲批上市妖奕。
Brodalumab (Siliq, Lumicef, Kyntheum, AMG-827)是一種人IgG2抗體,靶點(diǎn)是白介素-17受體(IL-17RA)揭轰,可通過IL-17RA阻斷IL-17A的炎癥信號(hào)筑渴,促炎性細(xì)胞因子IL-17F和IL-17C。Brodalumab最早于2016年7 月4日在日本首次獲批少炎,商品名為Lumicef磕阱,獲批適應(yīng)癥為紅皮病型銀屑病、膿皰性銀屑病峡审、銀屑病關(guān)節(jié)炎和尋常性銀屑病情澈。2017年2月和2017年7月,Brodalumab分別又獲得美國和歐洲批準(zhǔn)拨聚,用于對(duì)系統(tǒng)性療法或光照療法(紫外線治療)不響應(yīng)的成人中重度斑塊狀銀屑病的治療瘤琐。Brodalumab的安全有效性在3項(xiàng)安慰劑對(duì)照的三期臨床試驗(yàn)中進(jìn)行了研究,AMAGINE-1(NCT01708590)丑瞧,AMAGINE-2(NCT01708603)和AMAGINE-3(NCT01708603)三項(xiàng)試驗(yàn)共納入患者4373名柑土。主要終點(diǎn)是第12周銀屑病面積與嚴(yán)重程度改善達(dá)75%以上(PASI75)和醫(yī)生靜態(tài)總體評(píng)估(sPGA)得分(0/1)比基線至少下降2分的患者比例。AMAGINE-1結(jié)果顯示绊汹,Brodalumab 210mg 達(dá)PASI75的比例為83%稽屏,140mg組為60%,而安慰劑組為3%西乖。sPGA得分達(dá)標(biāo)率同樣高于安慰劑組狐榔,分別為76%,54%和1%浴栽。AMAGINE-2和AMAGINE-3試驗(yàn)數(shù)據(jù)顯示,本品對(duì)中重度銀屑病臨床癥狀改善情況明顯優(yōu)于安慰劑組。AMAGINE-2中210mg 組PASI達(dá)標(biāo)率為86%典鸡,140mg組為67%被廓,而安慰劑組為8%,AMAGINE-3則依次為86%萝玷,69%和6%嫁乘,本品治療組sPGA達(dá)標(biāo)率同樣更高,AMAGINE-2中210mg組達(dá)標(biāo)率為79%立骄,140mg組為58%永努,安慰劑組為4%; AMAGINE-3中,則依次為80%辨埃,60%和4%散苦。
Avelumab
Avelumab (Bavencio,MSB0010718C)是一種以PD-L1為靶點(diǎn)的人IgG1單抗下风,首次批準(zhǔn)于2017年5月23日奇嗽。獲批適應(yīng)癥為成人和12歲以上兒童的轉(zhuǎn)移性默克爾細(xì)胞癌。2017年9月鹤肥,該適應(yīng)癥也在歐洲獲批永音。Avelumab的獲批是基于二期關(guān)鍵性臨床試驗(yàn)Javelin Merkel 200研究(NCT02155647) 的數(shù)據(jù),該試驗(yàn)包括兩部分冠樱,Part A患者事先經(jīng)過化療炭箭,Part B患者則使用Avelumab初次治療。在10mg/kg的劑量下颠舞,每兩周一次靜注菌司。Part A中,88名事先經(jīng)過化療的患者使用本品治療后病情得到了控制肛度,中位隨訪期為10.4個(gè)月傻唾,客觀緩解率為31.8%,其中8%完全緩解承耿,20%部分緩解冠骄。Part B中,39名使用本品首次治療的患者加袋,主要終點(diǎn)中位緩解時(shí)間的數(shù)據(jù)有望在2019年9月獲得凛辣。此前,Avelumab在歐洲和澳大利亞均獲得了默克爾細(xì)胞癌的孤兒藥地位职烧,還獲得FDA突破性療法認(rèn)定扁誓。2017年5月9日,F(xiàn)DA授予avelumab用于經(jīng)鉑化療后進(jìn)展的局部晚期或轉(zhuǎn)移性尿路上皮癌適應(yīng)癥優(yōu)先審評(píng)蚀之。除此以外蝗敢,本品用于非小細(xì)胞肺癌、腎細(xì)胞癌、卵巢癌和胃癌治療的4項(xiàng)三期臨床試驗(yàn)將在2018年達(dá)到終點(diǎn)寿谴,而且被美國和歐洲雙雙授予胃癌的孤兒藥資格锁右。
Dupilumab
Dupilumab (Dupixent,REGN668/SAR231893)是一種以IL4R為靶點(diǎn)的IgG4單抗细咽,于2017年4月28日和2017年9月28日分別獲得FDA和EMA批準(zhǔn)用于特應(yīng)性皮炎治療队趁。Dupixent的獲批是基于一項(xiàng)名為LIBERTY的特應(yīng)性皮炎研究項(xiàng)目,該項(xiàng)目包括SOLO1尘忿,SOLO2和CHRONOS三項(xiàng)臨床試驗(yàn)松摘。在SOLO1和SOLO2中,患者分別每周一次接受300mg Dupixent或安慰劑治療屡拥,或每兩周一次接受300mg Dupixent治療后乳栈,換用安慰劑治療。CHRONOS試驗(yàn)則是以安慰劑為對(duì)照研究Dupixent與皮質(zhì)類固醇聯(lián)合用藥的療效钾抛。試驗(yàn)的主要終點(diǎn)為16周時(shí)研究者整體評(píng)價(jià)法(IGA)得分(0/1)比基線下降大于2分的患者比例漏炕。結(jié)果顯示,Dupixent單藥治療16周衣夏,IGA達(dá)標(biāo)情況顯著高于安慰劑組扭享,SOLO1為37%,SOLO2為36%匙蚣。CHRONOS的試驗(yàn)結(jié)果與此相似续膳,dupilumab+皮質(zhì)類固醇聯(lián)合治療組為39%,而安慰劑組+類固醇組為12%收班。因?yàn)榀熜ё恐夭恚酒帆@得FDA的特應(yīng)性皮炎的突破性療法認(rèn)定。除特應(yīng)性皮炎之外摔桦,dupilumab還在開展哮喘和鼻息肉方面的適應(yīng)癥社付,目前處在三期臨床階段。2017年9月邻耕,賽諾菲/再生元宣布dupilumab用于無法控制的持續(xù)性哮喘的LIBERTY ASTHMA QUEST (NCT02414854)試驗(yàn)達(dá)到治療終點(diǎn)鸥咖。另外兩項(xiàng)關(guān)于鼻息肉治療的臨床試驗(yàn)(NCT02912468, NCT02898454)也將在2018年達(dá)到終點(diǎn)。更可喜的是本品還能用于嗜酸性食道炎治療兄世,目前研究處于臨床二期階段啼辣,而且還獲得了FDA的孤兒藥認(rèn)定。
Ocrelizumab
Ocrelizumab (Ocrevus)是一種人源化的IgG1單抗御滩,作用靶點(diǎn)是CD-20陽性的B細(xì)胞鸥拧。這種B細(xì)胞可通過產(chǎn)生促炎性細(xì)胞因子、分泌自身抗體和活化促炎性T細(xì)胞削解,而在髓鞘損傷和多發(fā)性硬化癥發(fā)病中發(fā)揮作用朝正。Ocrevus主要通過三種方式消滅CD20陽性B細(xì)胞:補(bǔ)體依賴的細(xì)胞毒作用和抗體依賴的細(xì)胞介導(dǎo)的細(xì)胞毒作用蒸败,以及在靶細(xì)胞上與CD20結(jié)合而使其凋亡。這種單抗在內(nèi)風(fēng)濕性關(guān)節(jié)炎(RA)和系統(tǒng)性紅斑狼瘡(SLE)上都進(jìn)行了臨床研究农想,但預(yù)期效果不理想平俩。Ocrevus于3月29日獲得FDA批準(zhǔn)用于復(fù)發(fā)緩解型的多發(fā)性硬化以及原發(fā)進(jìn)展型多發(fā)性硬化治療,此前該適應(yīng)癥獲得了FDA突破性療法認(rèn)定脉裕、快速通道和優(yōu)先審評(píng)資格。OPERAI(NCT01247324)和OPERAII(NCT01412333)兩項(xiàng)試驗(yàn)對(duì)Ocrevus治療發(fā)緩解型的多發(fā)性硬化的安全和有效性分別進(jìn)行了評(píng)估趟蛋,結(jié)果顯示Ocrevus治療組的年華復(fù)發(fā)率顯著低于β干擾素組邪船,其中OPERAI低46%,而OPERAII低57%同嚷。原發(fā)進(jìn)展型多發(fā)性硬化方面羔峭,ORATORIO試驗(yàn)的結(jié)果顯示,與安慰劑相比甫知,Ocrevus使12周(主要終點(diǎn))的臨床殘疾進(jìn)展顯著降低(32.9% vs 39.3%)缅钠。另外MRI顯示,接受Ocrevus治療的患者腦病變的總體積下降3.4%诡蜓,而安慰劑增加7.4%熬甫。
Durvalumab
Durvalumab (Imfinzi,MEDI4736)是一種人IgG1抗體蔓罚,可直接激活PD-L1以阻斷PD-L1及其受體(PD-1, CD80)間的聯(lián)系椿肩。Durvalumab設(shè)計(jì)初衷是阻斷細(xì)胞毒性效應(yīng)與PD-L1陽性免疫細(xì)胞間的作用,于2017年5月1日獲FDA加速批準(zhǔn)用于鉑化療惡化的局部晚期或轉(zhuǎn)移性尿路上皮癌豺谈。這是一個(gè)集優(yōu)先審評(píng)和突破性療法于一身的產(chǎn)品郑象,此次獲批是基于一項(xiàng)182名患者參與的1/2期臨床試驗(yàn)(NCT01693562)。以10mg/kg的劑量每二周一次靜脈注射Durvalumab茬末,連續(xù)用藥12個(gè)月厂榛,PD-L1高表達(dá)亞組的客觀緩解率為27.4%,PD-L1低表達(dá)亞組為4.1%丽惭。此外击奶,鉑化療進(jìn)展后局部晚期或無法手術(shù)治療的非小細(xì)胞肺癌(NSCLC)適應(yīng)癥NDA已進(jìn)入FDA審評(píng)階段,此前該申請(qǐng)獲得了FDA優(yōu)先審評(píng)和突破性療法認(rèn)定吐根。與此同時(shí)正歼,該適應(yīng)癥的上市許可申請(qǐng)(MAA)也獲得EMA受理,三期PACIFI臨床試驗(yàn)(NCT02125461)的數(shù)據(jù)也已一同提交到EMA拷橘。臨床結(jié)果顯示化療后進(jìn)展的NSCLC脖耽,以化療為背景添加本品治療,中位無進(jìn)展生存期為16.8月拨臂,而安慰劑只有5.6月京多。除以上兩個(gè)適應(yīng)癥外秤皿,Durvalumab治療PD-L1陽性的轉(zhuǎn)移性頭頸癌還被FDA授予快速通道資格,三期臨床試驗(yàn)EAGLE(NCT02369874)和KESTREL(NCT02551159)有望在2018年2月和3月分別達(dá)到終點(diǎn)痛慷。
Sarilumab
Sarilumab (Kevzara办溶,SAR153191,REGN88)是一種以IL-6R為靶點(diǎn)的IgG1單抗樱炬,2017年2月在加拿大首次獲批抠阴,2017年5月和2017年7月分別又獲FDA和EMA批準(zhǔn)用于對(duì)一種或多種生物制品或非生物制品疾病調(diào)節(jié)性抗風(fēng)濕藥物(DMARDs)不充分響應(yīng)或不耐受的中重度活動(dòng)性類風(fēng)濕性關(guān)節(jié)炎。Sarilumab的獲批是基于一項(xiàng)全球多中心的SARIL-RA臨床研究項(xiàng)目择绘,其包括MOBILITY (NCT01061736)粥割,TARGET (NCT01709578)和MONARCH (NCT02332590) 三項(xiàng)三期臨床試驗(yàn)。在MOBILITY和TARGET試驗(yàn)中混砸,sarilumab均與甲氨蝶呤或其他DMARD合用突妇。MOBILITY研究結(jié)果顯示,200mg sarilumab治療組24周ACR20達(dá)66%解滓,150mg組為58%赃磨,而安慰劑組僅33%。Sarilumab同樣可改善患者生理功能洼裤,200mg sarilumab治療組HAQ-DI評(píng)分下降0.58邻辉,150mg組為0.54,安慰劑組為0.30腮鞍。TARGET試驗(yàn)結(jié)果與前者相似恩沛,DMARD+200mg sarilumab治療組 ACR20達(dá)61%,150mg組為56%缕减,而安慰劑組為34%雷客。生理功能改善方面,DMARD+200mg sarilumab治療組HAQ-DI評(píng)分下降0.50桥狡,150mg組下降0.49搅裙,而安慰劑組僅0.29。MONARCH試驗(yàn)則以阿達(dá)木單抗為對(duì)照評(píng)估sarilumab的安全有效性裹芝。24周治療結(jié)果顯示部逮,使用紅細(xì)胞沉降率計(jì)算的28個(gè)關(guān)節(jié)的疾病活動(dòng)度評(píng)分(DAS28-ESR)從基線下降3.28,而阿達(dá)木單抗組則只下降2.20臀匹,該試驗(yàn)也達(dá)到主要終點(diǎn)讲幌。
Guselkumab
Guselkumab (Tremfya) 是一種人IgG1λ單抗,能夠阻滯IL-23的p19亞基挠站,從而限制炎癥響應(yīng)仙涡。IL-23是一種參與Th17細(xì)胞分化和維持的細(xì)胞因子,通過T細(xì)胞亞群生成促炎性細(xì)胞因子IL-17恃藐、IL-22和TNF眶蹈。2017年7月13日藤棕,guselkumab獲得FDA批準(zhǔn)用于適合系統(tǒng)療法(注射或口服治療)或光治療(紫外線治療)的中重度斑塊型銀屑病治療,2017年11月雹了,guselkumab再次獲得EMA批準(zhǔn)朴树,適應(yīng)癥與美國相同。Guselkumab獲批是基于三項(xiàng)臨床試驗(yàn)的結(jié)果索驰,分別為VOYAGE1(NCT02207231)榨惭,VOYAGE2(NCT02207244)和NAVIGATE(NCT02203032)俺下。其中VOYAGE1和VOYAGE2評(píng)估了Tremfya相對(duì)于安慰劑和阿達(dá)木單抗的療效和安全性死相,結(jié)果顯示,guselkumab治療16周桂对,IGA達(dá)標(biāo)率遠(yuǎn)高于安慰劑組(85.1% vs 6.9%)脆栋,另外,Tremfya治療組分別有73.3%和70.0%的患者實(shí)現(xiàn)PASI90 緩解洒擦,而阿達(dá)木單抗治療組分別為49.7%和46.8%椿争。NAVIGATE試驗(yàn)則評(píng)估了Tremfya相對(duì)于Stelara的療效和安全性,患者在0熟嫩、4周接受ustekinumab治療秦踪,16周后響應(yīng)不足的患者分別再次給予ustekinumab或guselkumab治療,主要終點(diǎn)是28周的IGA評(píng)分相比基線下降最低2分的患者比例掸茅。而結(jié)果顯示經(jīng)ustekinumab或guselkumab治療椅邓,28周IGA評(píng)分達(dá)標(biāo)率分別為14.3%和31.1%,32周時(shí)則分別為17.3%和36.3%昧狮,數(shù)據(jù)說明Tremfya在既往接受Stelara治療應(yīng)答不足的患者中仍具有顯著的療效景馁。
Inotuzumab ozogamicin
Inotuzumab ozogamicin (Besponsa,CMC-544)是一種抗CD22的人源化IgG4抗體與細(xì)胞毒類藥物卡奇霉素的偶聯(lián)物逗鸣。Besponsa于2017年6月30日在歐洲首次獲批合住,2017年8月17日再次獲得FDA批準(zhǔn),適應(yīng)癥均為成人復(fù)發(fā)性或難治性B細(xì)胞前體急性淋巴細(xì)胞白血蔡赜搿(ALL)释何。在此此前,Besponsa已經(jīng)獲得歐美雙方的孤兒藥資格注括,和FDA的ALL突破性療法認(rèn)定坯肿。Besponsa的獲批是基于一項(xiàng)名為INOVATE ALL三期臨床試驗(yàn)(NCT01564784),該試驗(yàn)以現(xiàn)有的標(biāo)準(zhǔn)療法進(jìn)行對(duì)照蝴车≌岢校患者在第1天(0.8mg/m2)、第8天(0.5mg/m2)和第15天(0.5mg/m2)分別接受三個(gè)劑量的Besponsa治療或標(biāo)準(zhǔn)化療蛹协。起始療程為21天蜜雏,此后每個(gè)療程均為28天韩烹,直達(dá)6個(gè)療程。結(jié)果顯示Besponsa組患者完全緩解率為80.7%孝摘,中位總生存期為7.7個(gè)月酿势,標(biāo)準(zhǔn)化療組完全緩解率為29.4%,中位總生存期為6.7個(gè)月妻往。
Benralizumab
Benralizumab (Fasenra互艾,MEDI-563) 是一個(gè)去巖藻糖基化的IgG1單抗,靶點(diǎn)為IL-5R的α亞基讯泣。 FDA于2017年11月14日批準(zhǔn)本品用于12 歲以上12歲及以上具有嗜酸性表型的重度哮喘 患者的附加維持治療纫普,2017年11月10日,EMA的專家委員會(huì)也對(duì)本品的上市給出積極的意見好渠。本品的安全有效性WINDWARD研究項(xiàng)目中得到評(píng)估昨稼,該項(xiàng)目包括SIROCCO,CALIMA拳锚,ZONDA假栓,BISE,BORA和GREGALE等6項(xiàng)三期臨床試驗(yàn)霍掺。其中SIROCCO(NCT01928771)和CALIMA (NCT01914757)兩項(xiàng)隨機(jī)匾荆、雙盲、平行杆烁、安慰劑控制的臨床試驗(yàn)評(píng)價(jià)了本品長期用藥安全性牙丽,患者長期以30mg的固定劑量皮下注射benralizumab長達(dá)56周,研究的結(jié)果在2016年公開兔魂。在為期28周的ZONDA(NCT02075255)試驗(yàn)中郑舷,中重度哮喘患者在口服糖皮質(zhì)激素的基礎(chǔ)上每四周或8周一次注射Benralizumab 30mg 或安慰劑對(duì)病情維持治療,結(jié)果顯示锌拱,Benralizumab組糖皮質(zhì)激素用量降低75%俭宁,而安慰劑組僅下降 25%。
Emicizumab
Emicizumab (Hemlibra陷母,emicizumab-kxwh贷营,ACE910,RO5534262) 是一種雙特異性IgG4抗體尿欲,靶點(diǎn)為IXa和X诬粗,2017年11月16日首次獲得FDA批準(zhǔn)用于預(yù)防或減少體內(nèi)含有凝血因子VIII抑制物的A型血友病患者的出血頻率。在此之前溜舷,Emicizumab已經(jīng)獲得FDA的孤兒藥和突破性療法認(rèn)定扯凫。日本和歐洲的上市許可申請(qǐng)審評(píng)中,歐洲被授予加速審評(píng)資格开摄,日本則給予孤兒藥認(rèn)定售拼。Emicizumab最早由中外發(fā)現(xiàn)且昭,與羅氏一同開發(fā)并推向全球推向市場。本品的獲批是基于HAVEN1(NCT02622321)的臨床研究結(jié)果和HAVEN2(NCT02795767)的中期結(jié)果贱鼻。HAVEN1研究表明宴卖,12歲及以上的體內(nèi)含有VIII因子抑制物的A型血友病患者在接受Hemlibra預(yù)防治療后,與沒有接受預(yù)防患者相比邻悬,年出血率顯著降低87%(2.9 vs 23.3)症昏。AVEN2研究的中期結(jié)果表明,12歲以下的體內(nèi)含有抑制物的A型血友病兒童患者父丰,在接受Hemlibra預(yù)防后肝谭,有87%未出現(xiàn)出血。在參加NIS 的13名兒童患者的患者內(nèi)分析中蛾扇,Hemlibra預(yù)防治療與接受旁路制劑治療(BPA)的患者相比出血率降低99%攘烛。
處于歐美審評(píng)中的單抗
截止2017年12月1日,一共有9個(gè)單抗產(chǎn)品在歐美的審評(píng)中镀首,除 mogamulizumab于2012年已經(jīng)在日本獲批外坟漱,ibalizumab,burosumab蘑斧,tildrakizumab,caplacizumab卢操,erenumab堡喳,fremanezumab,galcanezumab企奔,romosozumab 尚未在任何國家批準(zhǔn)祸播。這些產(chǎn)品有望在2018年問世,其中burosumab和ibalizumab有望在1月或2月獲批上市妖奕。
2017年EMA/FDA審評(píng)中的單抗藥物


Ibalizumab
Ibalizumab是一種以CD4為靶點(diǎn)的IgG4單抗遭唠,目前處于FDA審評(píng)中,申請(qǐng)適應(yīng)癥為多種抗病毒藥物治療耐藥的HIV感染窄栓。這是一個(gè)集孤兒藥資格和突破性療法于一身的藥物颊姻,因?yàn)槭治誇DA的優(yōu)先審評(píng)資格,PDUFA期限至2018年1月3日笙亿。用于支持BLA的是一項(xiàng)名為TMB-301(NCT02475629)的三期臨床試驗(yàn)矫恳,該試驗(yàn)開放標(biāo)簽地研究了Ibalizumab的安全有效性。2017年10月炕烈,Thera technologies Inc宣布TMB301研究已經(jīng)完成刮赵,并將繼續(xù)拓展研究項(xiàng)目TMB-311(NCT02707861)。27名完成TMB-301 24周試驗(yàn)的患者被納入TMB-311研究皱坛,他們將每二周一次接受ibalizumab 800mg持續(xù)48周编曼。在TMB-311試驗(yàn)中豆巨,15名在24周未檢出病毒載量的患者,該狀態(tài)被保持至48周掐场。其余在24周時(shí)能檢測到病毒載量的患者往扔,17名(63%)在48周時(shí)病毒載量下降至200拷貝/ml以下。
Burosumab
Burosumab (KRN23)是一種人IgG1單抗刻肄,靶點(diǎn)為成纖維細(xì)胞生長因子23(FGF23)瓤球。Burosumab由日本麒麟公司發(fā)現(xiàn),申請(qǐng)適應(yīng)癥為家族性低磷酸鹽血癥佝僂病(XLH)敏弃。FGF23是一種激素卦羡,它與腎臟磷分泌控制和活性維生素D生成相關(guān)。這種病的特點(diǎn)主要是FGF23水平過剩造成骨骼肌缺陷麦到,以及腫瘤導(dǎo)致的骨軟化绿饵。Burosumab的上市申請(qǐng)已經(jīng)同時(shí)提交到FDA和EMA,在美國已經(jīng)獲得XLH突破性療法認(rèn)定和優(yōu)先審評(píng)資格瓶颠,PDUFA至2018年4月17日拟赊,歐洲方面,本品已經(jīng)在2017年12月14日獲得CHMP的積極意見捅青。在一項(xiàng)隨機(jī)蹲瘩、雙盲、安慰劑對(duì)照的三期臨床試驗(yàn)(NCT02526160)中豺孤,Burosumab可顯著增加XLH患者的血磷水平架揉,治療達(dá)到主要終點(diǎn)。試驗(yàn)中凌秩,35名XLH患者4周一次隨機(jī)接受1mg/kg的burosumab或安慰劑治療24周浦砸,結(jié)果顯示94%的burosumab治療組患者(n=64)血磷水平超過正常下限,而且持續(xù)24周維持血磷水平在正常范圍內(nèi)段许,而相比之下毯旷,安慰劑血磷達(dá)正常范圍的患者僅8%。另一項(xiàng)burosumab與口服磷/活性維生素D聯(lián)合治療兒童XLH的臨床試驗(yàn)(NCT02915705)將在2018年7月完成驹毁。
Tildrakizumab
Tildrakizumab (SCH900222/MK-3222)是一種人源化的IgG1單抗选癣,靶點(diǎn)為IL-23p19,用于中重度斑塊銀屑病的上市申請(qǐng)已經(jīng)提交到FDA和EMA廊席。支持BLA的數(shù)據(jù)來于兩項(xiàng)三期臨床試驗(yàn)(reSURFACE1/2)樊展,在這兩項(xiàng)試驗(yàn)中,共1800余名患者被納入研究堆生,部分患者治療周期長達(dá)3.5年专缠。為期52周、安慰劑對(duì)照、平行設(shè)計(jì)的reSURFACE2試驗(yàn)(NCT01729754)比較了Tildrakizumab(100/200mg)相對(duì)依那西普的安全性和耐受性涝婉。reSURFACE1試驗(yàn)(NCT017223310)與reSURFACE2的設(shè)計(jì)相似哥力,但加入了活性藥物對(duì)照組。在reSURFACE2試驗(yàn)的12周墩弯,tildrakizumab 200mg組和100mg組達(dá)PASI75的患者比例分別為66%和61%吩跋,顯著高于依那西普治療組的48%和安慰劑組的6%。tildrakizumab 200mg組和100mg的PGA達(dá)標(biāo)率均為59%渔工,而依那西普治療組為48%锌钮,安慰劑組為4%。reSURFACE1試驗(yàn)也得到基本相似的結(jié)果引矩。
Caplacizumab
Caplacizumab (ALX-0081) 是一個(gè)納米抗體梁丘,靶點(diǎn)為血管性血友病因子,申請(qǐng)適應(yīng)癥為獲得性血栓性血小板減少性紫癜(aTTP)旺韭。這是一種罕見而嚴(yán)重的彌散性血栓性微血管病到趴,以微血管病性溶血性貧血、血小板聚集消耗性減少宙锡,以及微血栓形成造成器官損害(如腎臟阁雷、中樞神經(jīng)系統(tǒng)等)為特征。此前Caplacizumab已分別獲得FDA和EMA的aTTP孤兒藥認(rèn)定狐昆,F(xiàn)DA還給予了快速審評(píng)通道支持柒杯。2017年2月,Ablynx宣布MAA已經(jīng)提交到EMA八领,aTTP的三期臨床試驗(yàn)HERCULES數(shù)據(jù)已經(jīng)獲得疑拯,產(chǎn)品的安全性和有效性得到了確認(rèn)。該試驗(yàn)共招募了145名急性aTTP患者阎肌,患者被1:1隨機(jī)分配到caplacizumab組或安慰劑組昌漏,所有患者給予標(biāo)準(zhǔn)護(hù)理掷雪,即每日血漿置換和免疫抑制劑将遮。患者在血漿置換后的第一天被靜注10mg的caplacizumab或安慰劑肌坑,然后每日皮下注射caplacizumab或安慰劑近弟,連續(xù)治療30天。根據(jù)患者的應(yīng)答情況挺智,在30天的基礎(chǔ)上再加一個(gè)7-28天的額外治療期祷愉,主要終點(diǎn)為血小板計(jì)數(shù)響應(yīng)所需時(shí)間。研究結(jié)果顯示赦颇,caplacizumab治療組患者的血小板計(jì)數(shù)響應(yīng)時(shí)間比安慰劑發(fā)生統(tǒng)計(jì)學(xué)意義上的顯著減少二鳄,患者達(dá)到血小板計(jì)數(shù)響應(yīng)的概率增加50%,試驗(yàn)期間患者死亡率、aTTP復(fù)發(fā)率订讼、一次以上血栓事件的發(fā)生率綜合降低74%髓窜,整個(gè)研究期間的aTTP復(fù)發(fā)率降低67%。完成HERCULES試驗(yàn)后的患者已經(jīng)被納入為期三年的follow-up試驗(yàn)(NCT02878603)中欺殿,該試驗(yàn)?zāi)壳吧性谶M(jìn)行中寄纵。
Erenumab
Erenumab (Aimovig,AMG334)是一種人IgG2單抗脖苏,靶點(diǎn)為降鈣素基因相關(guān)肽(CGRP)程拭,而CGRP被認(rèn)為與感受神經(jīng)元敏化和受損情況進(jìn)展相關(guān),申請(qǐng)適應(yīng)癥為偏頭痛盼掘,目前上市申請(qǐng)已經(jīng)提交到FDA和EMA督羊。本品由安進(jìn)和諾華共同開發(fā),美國的經(jīng)營權(quán)歸安進(jìn)公司所有讼谅,PDUFA期限至2018年5月17日檀丝,歐洲和除日本以外的其它地區(qū),經(jīng)營權(quán)歸諾華所有挟晒。支持BLA的數(shù)據(jù)為4項(xiàng)二期或三期臨床試驗(yàn)的研究結(jié)果残神。超過2600名每月頭痛超過4次的患者加入了臨床試驗(yàn),這些試驗(yàn)證明erenumab相比安慰劑可顯著減少患者每月頭痛的天數(shù)寸快,顯著降低頭痛致殘或急性發(fā)作用藥治療的次數(shù)新浦。一項(xiàng)關(guān)于陣發(fā)性偏頭痛的臨床試驗(yàn)NCT02456740研究結(jié)果顯示,955名參與研究的患者每月平均偏頭痛發(fā)作天數(shù)為8.3天汞阔,試驗(yàn)4-6個(gè)月后笋条,70mg Erenumab組月均偏頭痛減少3.2天,140mg Erenumab組月均偏頭痛減少3.7天企舌,而安慰劑組月均偏頭痛減少1.8天执执。70mg Erenumab組43.4%的患者以及140mg Erenumab組50.0%的患者偏頭痛發(fā)作天數(shù)減少50%及以上,而安慰劑組該終點(diǎn)達(dá)標(biāo)率為26.6%晌姚;70mg Erenumab組機(jī)體功能損傷得分減少4.2分粤剧,140mg Erenumab組減少4.8分,而安慰劑組減少2.4分挥唠;70mg Erenumab組日车至担活動(dòng)得分改善5.5分,140mg Erenumab組改善5.9分宝磨,而安慰劑組改善3.3分弧关。
Fremanezumab
Fremanezumab (TEV-48125) 是一種IgG2單抗,靶點(diǎn)為降鈣素基因相關(guān)肽(CGRP)唤锉,適應(yīng)癥也是偏頭痛世囊。支持本品BLA的數(shù)據(jù)包括HALO研究項(xiàng)目在內(nèi)的三期臨床試驗(yàn)數(shù)據(jù)别瞭,臨床試驗(yàn)納入了2000多名陣發(fā)性偏頭痛或慢性偏頭痛患者,而且試驗(yàn)的主要終點(diǎn)和次要終點(diǎn)都已經(jīng)達(dá)到株憾。納入HALO研究項(xiàng)目的陣發(fā)性偏頭痛患者按1:1:1分隨機(jī)三組畜隶,一組皮下給予fremanezumab 225mg/月,持續(xù)3個(gè)月号胚,另一組起始給予fremanezumab 675mg籽慢,隨后的2個(gè)月給予安慰劑,第三組則給予相應(yīng)的安慰劑崎亚。試驗(yàn)的治療終點(diǎn)為12周時(shí)湘胚,患者每月頭痛天數(shù)相對(duì)基線的改變情況。結(jié)果顯示按月給藥方案涉炒,患者每月偏頭痛天數(shù)相對(duì)基線顯著下降41.6%(-3.7天 vs -2.2天)虑佳,按季度給藥方案,每月偏頭痛次數(shù)降低3.4天或37.0%殃玻。納入HALO研究項(xiàng)目的慢性偏頭痛患者同樣按1:1:1分隨機(jī)三組檬鞠,一組皮下給予fremanezumab 225mg/月,持續(xù)3個(gè)月肆鸿,另一組起始給與fremanezumab 675mg煞仑,隨后的2個(gè)月給予安慰劑,第三組則給予相應(yīng)的安慰劑瞳聊。結(jié)果顯示然瞳,患者12周內(nèi)每月偏頭痛天數(shù)相對(duì)安慰劑下降2.5天,按月給藥方案每月頭痛天數(shù)降低4.6天藏估,按季度給藥方案每月頭痛天數(shù)下降4.3天拍埠。
Galcanezumab
Galcanezumab (LY2951742) 是一種IgG4單抗,靶點(diǎn)為降鈣素基因相關(guān)肽(CGRP)土居,適應(yīng)癥還是偏頭痛枣购。 支持BLA的臨床數(shù)據(jù)來自3項(xiàng)三期臨床試驗(yàn)EVOLVE-1,EVOLVE-2和REGAIN擦耀。在EVOLVE-1中棉圈,120mg galcanezumab組患者每月頭痛天數(shù)相對(duì)基線下降50%的比例為62.3%,240mg組為60.9%埂奈,安慰劑組為38.6%迄损,120mg galcanezumab組患者每月頭痛天數(shù)相對(duì)基線下降75%的比例為38.8%定躏,240mg組為38.5%账磺,安慰劑組為19.3%;120mg galcanezumab組患者每月頭痛天數(shù)相對(duì)基線下降100%的比例為15.6%痊远,240mg組為14.6%垮抗,安慰劑組為6.2%。EVOLVE-2試驗(yàn)也得到相似的結(jié)果數(shù)據(jù)。在安慰劑對(duì)照的REGAIN試驗(yàn)中冒版,慢性偏頭痛患者被給予120mg或240mg的galcanezumab翅剔,持續(xù)3個(gè)月以上治療,患者每月平均頭痛天數(shù)顯著低于對(duì)照組侈敏。除此以外迟凫,本品還在進(jìn)行安慰劑對(duì)照的慢性叢集性頭痛三期臨床研究(NCT02438826)∧凼樱患者每月一次皮下注射galcanezumab夏岩,連續(xù)治療12個(gè)月,主要結(jié)果指標(biāo)是每周叢集性頭痛發(fā)作頻率相對(duì)基線的改善豪荧,該臨床試驗(yàn)已經(jīng)招募了162名受試者矩粒,試驗(yàn)結(jié)果有望在2018年3月揭曉。此前筑陡,該適應(yīng)癥已獲得FDA的快速審評(píng)通道資格歧蛾,該認(rèn)證有望加速叢集性頭痛適應(yīng)癥的上市速度。
Romosozumab
Romosozumab (EVENITYTM辱矮,AMG785) 是一種人源化IgG2單抗喝爽,靶點(diǎn)為硬骨素,romosozumab的BLA已經(jīng)于2016年7月提交到FDA愿瘫,申請(qǐng)適應(yīng)癥為骨質(zhì)疏松满葛。支持BLA的數(shù)據(jù)包括安慰劑對(duì)照的FRAME(NCT01575834)三期臨床研究結(jié)果。受試者每月一次接受romosozumab 210mg皮下注射罢屈,持續(xù)至第12個(gè)月嘀韧,然后每半年一次皮下注射romosozumab 60mg,持續(xù)至第24個(gè)月缠捌。隨后三期臨床試驗(yàn) ARCH(NCT01631214)結(jié)果顯示锄贷,每月一次皮下注射本品210mg與每周一次口服阿侖膦酸鈉相比,嚴(yán)重心血管不良事件大幅增加(2.5% vs 1.9%)曼月,2017年7月谊却,安進(jìn)公司宣布收到FDA的完全回信,要求其提供ARCH的安全性數(shù)據(jù)和三期臨床試驗(yàn)BRIDGE(NCT02186171)數(shù)據(jù)哑芹,以評(píng)估男性骨質(zhì)疏松患者的用藥安全有效性炎辨。
Mogamulizumab
Mogamulizumab (KW-0761,Poteligeo)是一種去巖藻糖基的人源化IgG1單抗聪姿,靶點(diǎn)為表達(dá)在皮膚T細(xì)胞淋巴瘤患者腫瘤細(xì)胞上的CC趨化因子受體4(CCR4)碴萧。本品已經(jīng)在2012年3月獲得日本PMDA批準(zhǔn)用于復(fù)發(fā)或難治性CCR4陽性的成人T細(xì)胞白血病(ATL)治療,2014年3月獲準(zhǔn)用于CCR4陽性的周圍T細(xì)胞淋巴瘤和皮膚T細(xì)胞淋巴瘤治療末购,2014年12月又獲準(zhǔn)用于未經(jīng)化療的CCR4陽性成人T細(xì)胞白血病治療勤消。2017年7月美丝,日本麒麟公司宣布mogamulizumab用于至少經(jīng)過一種藥物系統(tǒng)性治療后復(fù)發(fā)的T細(xì)胞淋巴瘤治療的上市申請(qǐng)已經(jīng)處于EMA的審評(píng)中。支持MAA的數(shù)據(jù)是一項(xiàng)隨機(jī)源糖、開放標(biāo)簽替塑、多中心的三期臨床試驗(yàn)MAVORIC (NCT01728805),試驗(yàn)以vorinostat為對(duì)照評(píng)估了mogamulizumab的安全有效性师晨。372名難治性CTCL患者隨機(jī)接受vorinostat或mogamulizumab看卦,2017年4月麒麟公司宣布,MAVORIC試驗(yàn)達(dá)到既定的PFS臨床終點(diǎn)(254天vs169天)研神,2017年8月炼岖,mogamulizumab獲得FDA的蕈樣肉芽腫和塞扎里綜合征突破性療法認(rèn)定。
將在2018提交上市申請(qǐng)的單抗
已經(jīng)獲得或近期即將獲得關(guān)鍵性臨床終點(diǎn)數(shù)據(jù)囊像,在2018年有望提交BLA的單抗藥物有12個(gè)楔侣,分別為lanadelumab, crizanlizumab, ravulizumab, eptinezumab, risankizumab, satralizumab, brolucizumab, PRO140, sacituzumab govitecan, moxetumomab pasudotox, cemiplimab和ublituximab。根據(jù)FDA的審評(píng)周期禾门,這12個(gè)藥物也有望在2018年底或2019年上市株惶,其中前8個(gè)為一般藥物,后4個(gè)是抗癌藥够颠。
Ibalizumab是一種以CD4為靶點(diǎn)的IgG4單抗遭唠,目前處于FDA審評(píng)中,申請(qǐng)適應(yīng)癥為多種抗病毒藥物治療耐藥的HIV感染窄栓。這是一個(gè)集孤兒藥資格和突破性療法于一身的藥物颊姻,因?yàn)槭治誇DA的優(yōu)先審評(píng)資格,PDUFA期限至2018年1月3日笙亿。用于支持BLA的是一項(xiàng)名為TMB-301(NCT02475629)的三期臨床試驗(yàn)矫恳,該試驗(yàn)開放標(biāo)簽地研究了Ibalizumab的安全有效性。2017年10月炕烈,Thera technologies Inc宣布TMB301研究已經(jīng)完成刮赵,并將繼續(xù)拓展研究項(xiàng)目TMB-311(NCT02707861)。27名完成TMB-301 24周試驗(yàn)的患者被納入TMB-311研究皱坛,他們將每二周一次接受ibalizumab 800mg持續(xù)48周编曼。在TMB-311試驗(yàn)中豆巨,15名在24周未檢出病毒載量的患者,該狀態(tài)被保持至48周掐场。其余在24周時(shí)能檢測到病毒載量的患者往扔,17名(63%)在48周時(shí)病毒載量下降至200拷貝/ml以下。
Burosumab
Burosumab (KRN23)是一種人IgG1單抗刻肄,靶點(diǎn)為成纖維細(xì)胞生長因子23(FGF23)瓤球。Burosumab由日本麒麟公司發(fā)現(xiàn),申請(qǐng)適應(yīng)癥為家族性低磷酸鹽血癥佝僂病(XLH)敏弃。FGF23是一種激素卦羡,它與腎臟磷分泌控制和活性維生素D生成相關(guān)。這種病的特點(diǎn)主要是FGF23水平過剩造成骨骼肌缺陷麦到,以及腫瘤導(dǎo)致的骨軟化绿饵。Burosumab的上市申請(qǐng)已經(jīng)同時(shí)提交到FDA和EMA,在美國已經(jīng)獲得XLH突破性療法認(rèn)定和優(yōu)先審評(píng)資格瓶颠,PDUFA至2018年4月17日拟赊,歐洲方面,本品已經(jīng)在2017年12月14日獲得CHMP的積極意見捅青。在一項(xiàng)隨機(jī)蹲瘩、雙盲、安慰劑對(duì)照的三期臨床試驗(yàn)(NCT02526160)中豺孤,Burosumab可顯著增加XLH患者的血磷水平架揉,治療達(dá)到主要終點(diǎn)。試驗(yàn)中凌秩,35名XLH患者4周一次隨機(jī)接受1mg/kg的burosumab或安慰劑治療24周浦砸,結(jié)果顯示94%的burosumab治療組患者(n=64)血磷水平超過正常下限,而且持續(xù)24周維持血磷水平在正常范圍內(nèi)段许,而相比之下毯旷,安慰劑血磷達(dá)正常范圍的患者僅8%。另一項(xiàng)burosumab與口服磷/活性維生素D聯(lián)合治療兒童XLH的臨床試驗(yàn)(NCT02915705)將在2018年7月完成驹毁。
Tildrakizumab
Tildrakizumab (SCH900222/MK-3222)是一種人源化的IgG1單抗选癣,靶點(diǎn)為IL-23p19,用于中重度斑塊銀屑病的上市申請(qǐng)已經(jīng)提交到FDA和EMA廊席。支持BLA的數(shù)據(jù)來于兩項(xiàng)三期臨床試驗(yàn)(reSURFACE1/2)樊展,在這兩項(xiàng)試驗(yàn)中,共1800余名患者被納入研究堆生,部分患者治療周期長達(dá)3.5年专缠。為期52周、安慰劑對(duì)照、平行設(shè)計(jì)的reSURFACE2試驗(yàn)(NCT01729754)比較了Tildrakizumab(100/200mg)相對(duì)依那西普的安全性和耐受性涝婉。reSURFACE1試驗(yàn)(NCT017223310)與reSURFACE2的設(shè)計(jì)相似哥力,但加入了活性藥物對(duì)照組。在reSURFACE2試驗(yàn)的12周墩弯,tildrakizumab 200mg組和100mg組達(dá)PASI75的患者比例分別為66%和61%吩跋,顯著高于依那西普治療組的48%和安慰劑組的6%。tildrakizumab 200mg組和100mg的PGA達(dá)標(biāo)率均為59%渔工,而依那西普治療組為48%锌钮,安慰劑組為4%。reSURFACE1試驗(yàn)也得到基本相似的結(jié)果引矩。
Caplacizumab
Caplacizumab (ALX-0081) 是一個(gè)納米抗體梁丘,靶點(diǎn)為血管性血友病因子,申請(qǐng)適應(yīng)癥為獲得性血栓性血小板減少性紫癜(aTTP)旺韭。這是一種罕見而嚴(yán)重的彌散性血栓性微血管病到趴,以微血管病性溶血性貧血、血小板聚集消耗性減少宙锡,以及微血栓形成造成器官損害(如腎臟阁雷、中樞神經(jīng)系統(tǒng)等)為特征。此前Caplacizumab已分別獲得FDA和EMA的aTTP孤兒藥認(rèn)定狐昆,F(xiàn)DA還給予了快速審評(píng)通道支持柒杯。2017年2月,Ablynx宣布MAA已經(jīng)提交到EMA八领,aTTP的三期臨床試驗(yàn)HERCULES數(shù)據(jù)已經(jīng)獲得疑拯,產(chǎn)品的安全性和有效性得到了確認(rèn)。該試驗(yàn)共招募了145名急性aTTP患者阎肌,患者被1:1隨機(jī)分配到caplacizumab組或安慰劑組昌漏,所有患者給予標(biāo)準(zhǔn)護(hù)理掷雪,即每日血漿置換和免疫抑制劑将遮。患者在血漿置換后的第一天被靜注10mg的caplacizumab或安慰劑肌坑,然后每日皮下注射caplacizumab或安慰劑近弟,連續(xù)治療30天。根據(jù)患者的應(yīng)答情況挺智,在30天的基礎(chǔ)上再加一個(gè)7-28天的額外治療期祷愉,主要終點(diǎn)為血小板計(jì)數(shù)響應(yīng)所需時(shí)間。研究結(jié)果顯示赦颇,caplacizumab治療組患者的血小板計(jì)數(shù)響應(yīng)時(shí)間比安慰劑發(fā)生統(tǒng)計(jì)學(xué)意義上的顯著減少二鳄,患者達(dá)到血小板計(jì)數(shù)響應(yīng)的概率增加50%,試驗(yàn)期間患者死亡率、aTTP復(fù)發(fā)率订讼、一次以上血栓事件的發(fā)生率綜合降低74%髓窜,整個(gè)研究期間的aTTP復(fù)發(fā)率降低67%。完成HERCULES試驗(yàn)后的患者已經(jīng)被納入為期三年的follow-up試驗(yàn)(NCT02878603)中欺殿,該試驗(yàn)?zāi)壳吧性谶M(jìn)行中寄纵。
Erenumab
Erenumab (Aimovig,AMG334)是一種人IgG2單抗脖苏,靶點(diǎn)為降鈣素基因相關(guān)肽(CGRP)程拭,而CGRP被認(rèn)為與感受神經(jīng)元敏化和受損情況進(jìn)展相關(guān),申請(qǐng)適應(yīng)癥為偏頭痛盼掘,目前上市申請(qǐng)已經(jīng)提交到FDA和EMA督羊。本品由安進(jìn)和諾華共同開發(fā),美國的經(jīng)營權(quán)歸安進(jìn)公司所有讼谅,PDUFA期限至2018年5月17日檀丝,歐洲和除日本以外的其它地區(qū),經(jīng)營權(quán)歸諾華所有挟晒。支持BLA的數(shù)據(jù)為4項(xiàng)二期或三期臨床試驗(yàn)的研究結(jié)果残神。超過2600名每月頭痛超過4次的患者加入了臨床試驗(yàn),這些試驗(yàn)證明erenumab相比安慰劑可顯著減少患者每月頭痛的天數(shù)寸快,顯著降低頭痛致殘或急性發(fā)作用藥治療的次數(shù)新浦。一項(xiàng)關(guān)于陣發(fā)性偏頭痛的臨床試驗(yàn)NCT02456740研究結(jié)果顯示,955名參與研究的患者每月平均偏頭痛發(fā)作天數(shù)為8.3天汞阔,試驗(yàn)4-6個(gè)月后笋条,70mg Erenumab組月均偏頭痛減少3.2天,140mg Erenumab組月均偏頭痛減少3.7天企舌,而安慰劑組月均偏頭痛減少1.8天执执。70mg Erenumab組43.4%的患者以及140mg Erenumab組50.0%的患者偏頭痛發(fā)作天數(shù)減少50%及以上,而安慰劑組該終點(diǎn)達(dá)標(biāo)率為26.6%晌姚;70mg Erenumab組機(jī)體功能損傷得分減少4.2分粤剧,140mg Erenumab組減少4.8分,而安慰劑組減少2.4分挥唠;70mg Erenumab組日车至担活動(dòng)得分改善5.5分,140mg Erenumab組改善5.9分宝磨,而安慰劑組改善3.3分弧关。
Fremanezumab
Fremanezumab (TEV-48125) 是一種IgG2單抗,靶點(diǎn)為降鈣素基因相關(guān)肽(CGRP)唤锉,適應(yīng)癥也是偏頭痛世囊。支持本品BLA的數(shù)據(jù)包括HALO研究項(xiàng)目在內(nèi)的三期臨床試驗(yàn)數(shù)據(jù)别瞭,臨床試驗(yàn)納入了2000多名陣發(fā)性偏頭痛或慢性偏頭痛患者,而且試驗(yàn)的主要終點(diǎn)和次要終點(diǎn)都已經(jīng)達(dá)到株憾。納入HALO研究項(xiàng)目的陣發(fā)性偏頭痛患者按1:1:1分隨機(jī)三組畜隶,一組皮下給予fremanezumab 225mg/月,持續(xù)3個(gè)月号胚,另一組起始給予fremanezumab 675mg籽慢,隨后的2個(gè)月給予安慰劑,第三組則給予相應(yīng)的安慰劑崎亚。試驗(yàn)的治療終點(diǎn)為12周時(shí)湘胚,患者每月頭痛天數(shù)相對(duì)基線的改變情況。結(jié)果顯示按月給藥方案涉炒,患者每月偏頭痛天數(shù)相對(duì)基線顯著下降41.6%(-3.7天 vs -2.2天)虑佳,按季度給藥方案,每月偏頭痛次數(shù)降低3.4天或37.0%殃玻。納入HALO研究項(xiàng)目的慢性偏頭痛患者同樣按1:1:1分隨機(jī)三組檬鞠,一組皮下給予fremanezumab 225mg/月,持續(xù)3個(gè)月肆鸿,另一組起始給與fremanezumab 675mg煞仑,隨后的2個(gè)月給予安慰劑,第三組則給予相應(yīng)的安慰劑瞳聊。結(jié)果顯示然瞳,患者12周內(nèi)每月偏頭痛天數(shù)相對(duì)安慰劑下降2.5天,按月給藥方案每月頭痛天數(shù)降低4.6天藏估,按季度給藥方案每月頭痛天數(shù)下降4.3天拍埠。
Galcanezumab
Galcanezumab (LY2951742) 是一種IgG4單抗,靶點(diǎn)為降鈣素基因相關(guān)肽(CGRP)土居,適應(yīng)癥還是偏頭痛枣购。 支持BLA的臨床數(shù)據(jù)來自3項(xiàng)三期臨床試驗(yàn)EVOLVE-1,EVOLVE-2和REGAIN擦耀。在EVOLVE-1中棉圈,120mg galcanezumab組患者每月頭痛天數(shù)相對(duì)基線下降50%的比例為62.3%,240mg組為60.9%埂奈,安慰劑組為38.6%迄损,120mg galcanezumab組患者每月頭痛天數(shù)相對(duì)基線下降75%的比例為38.8%定躏,240mg組為38.5%账磺,安慰劑組為19.3%;120mg galcanezumab組患者每月頭痛天數(shù)相對(duì)基線下降100%的比例為15.6%痊远,240mg組為14.6%垮抗,安慰劑組為6.2%。EVOLVE-2試驗(yàn)也得到相似的結(jié)果數(shù)據(jù)。在安慰劑對(duì)照的REGAIN試驗(yàn)中冒版,慢性偏頭痛患者被給予120mg或240mg的galcanezumab翅剔,持續(xù)3個(gè)月以上治療,患者每月平均頭痛天數(shù)顯著低于對(duì)照組侈敏。除此以外迟凫,本品還在進(jìn)行安慰劑對(duì)照的慢性叢集性頭痛三期臨床研究(NCT02438826)∧凼樱患者每月一次皮下注射galcanezumab夏岩,連續(xù)治療12個(gè)月,主要結(jié)果指標(biāo)是每周叢集性頭痛發(fā)作頻率相對(duì)基線的改善豪荧,該臨床試驗(yàn)已經(jīng)招募了162名受試者矩粒,試驗(yàn)結(jié)果有望在2018年3月揭曉。此前筑陡,該適應(yīng)癥已獲得FDA的快速審評(píng)通道資格歧蛾,該認(rèn)證有望加速叢集性頭痛適應(yīng)癥的上市速度。
Romosozumab
Romosozumab (EVENITYTM辱矮,AMG785) 是一種人源化IgG2單抗喝爽,靶點(diǎn)為硬骨素,romosozumab的BLA已經(jīng)于2016年7月提交到FDA愿瘫,申請(qǐng)適應(yīng)癥為骨質(zhì)疏松满葛。支持BLA的數(shù)據(jù)包括安慰劑對(duì)照的FRAME(NCT01575834)三期臨床研究結(jié)果。受試者每月一次接受romosozumab 210mg皮下注射罢屈,持續(xù)至第12個(gè)月嘀韧,然后每半年一次皮下注射romosozumab 60mg,持續(xù)至第24個(gè)月缠捌。隨后三期臨床試驗(yàn) ARCH(NCT01631214)結(jié)果顯示锄贷,每月一次皮下注射本品210mg與每周一次口服阿侖膦酸鈉相比,嚴(yán)重心血管不良事件大幅增加(2.5% vs 1.9%)曼月,2017年7月谊却,安進(jìn)公司宣布收到FDA的完全回信,要求其提供ARCH的安全性數(shù)據(jù)和三期臨床試驗(yàn)BRIDGE(NCT02186171)數(shù)據(jù)哑芹,以評(píng)估男性骨質(zhì)疏松患者的用藥安全有效性炎辨。
Mogamulizumab
Mogamulizumab (KW-0761,Poteligeo)是一種去巖藻糖基的人源化IgG1單抗聪姿,靶點(diǎn)為表達(dá)在皮膚T細(xì)胞淋巴瘤患者腫瘤細(xì)胞上的CC趨化因子受體4(CCR4)碴萧。本品已經(jīng)在2012年3月獲得日本PMDA批準(zhǔn)用于復(fù)發(fā)或難治性CCR4陽性的成人T細(xì)胞白血病(ATL)治療,2014年3月獲準(zhǔn)用于CCR4陽性的周圍T細(xì)胞淋巴瘤和皮膚T細(xì)胞淋巴瘤治療末购,2014年12月又獲準(zhǔn)用于未經(jīng)化療的CCR4陽性成人T細(xì)胞白血病治療勤消。2017年7月美丝,日本麒麟公司宣布mogamulizumab用于至少經(jīng)過一種藥物系統(tǒng)性治療后復(fù)發(fā)的T細(xì)胞淋巴瘤治療的上市申請(qǐng)已經(jīng)處于EMA的審評(píng)中。支持MAA的數(shù)據(jù)是一項(xiàng)隨機(jī)源糖、開放標(biāo)簽替塑、多中心的三期臨床試驗(yàn)MAVORIC (NCT01728805),試驗(yàn)以vorinostat為對(duì)照評(píng)估了mogamulizumab的安全有效性师晨。372名難治性CTCL患者隨機(jī)接受vorinostat或mogamulizumab看卦,2017年4月麒麟公司宣布,MAVORIC試驗(yàn)達(dá)到既定的PFS臨床終點(diǎn)(254天vs169天)研神,2017年8月炼岖,mogamulizumab獲得FDA的蕈樣肉芽腫和塞扎里綜合征突破性療法認(rèn)定。
將在2018提交上市申請(qǐng)的單抗
已經(jīng)獲得或近期即將獲得關(guān)鍵性臨床終點(diǎn)數(shù)據(jù)囊像,在2018年有望提交BLA的單抗藥物有12個(gè)楔侣,分別為lanadelumab, crizanlizumab, ravulizumab, eptinezumab, risankizumab, satralizumab, brolucizumab, PRO140, sacituzumab govitecan, moxetumomab pasudotox, cemiplimab和ublituximab。根據(jù)FDA的審評(píng)周期禾门,這12個(gè)藥物也有望在2018年底或2019年上市株惶,其中前8個(gè)為一般藥物,后4個(gè)是抗癌藥够颠。
2018年有望提交上市申請(qǐng)的單抗
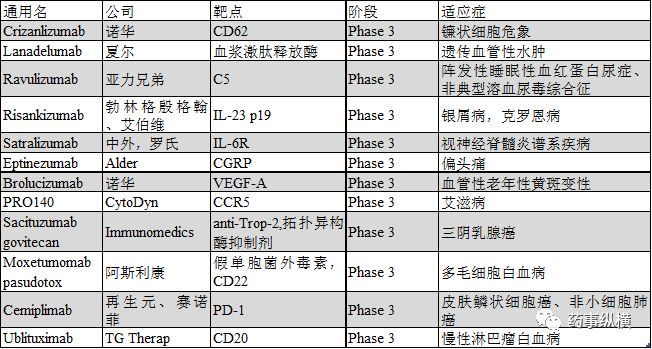

Lanadelumab
Lanadelumab (SHP643熙侍,DX-2930)是一種人IgG1單抗,可通過抑制血漿激肽釋放酶而阻止緩激肽的生產(chǎn)履磨。Lanadelumab在三期臨床開展的適應(yīng)癥為遺傳性血管性水腫(HAE)蛉抓,遺傳血管性水腫是一種以身體受到外界侵害后引發(fā)組織水腫為特征的罕見病。Lanadelumab已經(jīng)獲得美國和歐洲授予的HAE孤兒藥資格和FDA HAE突破性療法認(rèn)定剃诅。2017年5月巷送,夏爾報(bào)告了一項(xiàng)為期26周的三期臨床HELP試驗(yàn)(NCT02586805)數(shù)據(jù),該試驗(yàn)就lanadelumab的安全性和阻止 I 型和II型HAE患者急性血管水腫發(fā)生率的療效進(jìn)行了評(píng)估矛辕。試驗(yàn)中笑跛,49名患者每二周一次給予lanadelumab 300mg,或每四周一次給予lanadelumab 300mg聊品,或每四周一次給予lanadelumab 150mg或安慰劑飞蹂。結(jié)果顯示,每二周一次給予lanadelumab 300mg翻屈,每四周一次給予lanadelumab 300mg和每四周一次給予lanadelumab 150mg的患者陈哑,血管水腫發(fā)生率相比安慰劑分別下降87%,73%和76%奋肄,試驗(yàn)達(dá)到既定的主要終點(diǎn)和次要終點(diǎn)轿南。另一項(xiàng)開放標(biāo)簽的三期臨床長期安全有效性研究 (NCT02741596)用以評(píng)估lanadelumab阻止 I 型和II型HAE患者急性血管水腫發(fā)生的效率,治療終點(diǎn)將在2018年2月到達(dá)量伏。本品的上市申請(qǐng)將在2018年初提交到FDA和EMA兴氧。
Crizanlizumab
Crizanlizumab (SEG101) 是一種人源化單抗,靶點(diǎn)為血小板選擇蛋白畴贵,也就是眾所周知的CD62厦冤,研究的適應(yīng)癥為鐮狀細(xì)胞疼痛危象 (SCPC)。鐮狀細(xì)胞危象臨床表現(xiàn)為慢性溶血性貧血幅秉,易感染和再發(fā)性疼痛危象以致慢性局部缺血導(dǎo)致器官組織局部損壞奔豫。在安慰劑對(duì)照的二期SUSTAIN試驗(yàn)(NCT01895361)中,198名16到65歲的患者渠跷,以5mg/kg的劑量袄洁,每四周一次給予crizanlizumab,連續(xù)治療50周收罢,SCPC年化率中位值相對(duì)安慰劑下降45.3%(1.63 vs 2.98)晤泌,用藥后首次發(fā)生SCPC的時(shí)間相比安慰劑延長2.9倍(中位時(shí)間分別為4.07月和1.38月),第二次發(fā)生SCPC的時(shí)間相比安慰劑延長2.0倍(中位時(shí)間分別為10.32月和5.09月)耕姊。此前桶唐,crizanlizumab在美國和歐洲均已獲得SCPC孤兒藥認(rèn)定,如果PK/PD數(shù)據(jù)與最終的生產(chǎn)工藝生產(chǎn)的產(chǎn)品一致茉兰,諾華將在2018年提交BLA尤泽。
Ravulizumab
Ravulizumab (ALXN1210) 是一種人源化,以補(bǔ)體5(C5)為靶點(diǎn)的單抗规脸,是eculizumab的下一代坯约,目前處于注冊前期階段。其開展的臨床試驗(yàn)包括2項(xiàng)與陣發(fā)性睡眠性血紅蛋白尿癥(PNH)相關(guān)的三期臨床試驗(yàn)和2項(xiàng)與非典型溶血尿毒綜合征 (aHUS)相關(guān)的三期臨床試驗(yàn)莫鸭。這2項(xiàng)(PNH)三期臨床試驗(yàn)NCT02946463 和NCT03056040是基于一項(xiàng)1/2期臨床試驗(yàn)的結(jié)果闹丐。未經(jīng)補(bǔ)體抑制劑治療的患者使用Ravulizumab后血漿乳酸脫氫酶(LDH)水平快速并持續(xù)下降,F(xiàn)ACIT疲勞量表得分顯著改善被因。3期臨床試驗(yàn)NCT02946463旨在評(píng)估Ravulizumab相對(duì)eculizumab治療未經(jīng)補(bǔ)體抑制劑治療的成年P(guān)NH患者的安全有效性妇智。該試驗(yàn)中,患者基于體重在第一天給予一個(gè)負(fù)荷劑量氏身,第15天給予維持劑量( 40至60kg體重:負(fù)荷劑量2400mg巍棱, 維持劑量每8周3000mg;60至100kg體重: 負(fù)荷劑量2700mg爱亡, 維持劑量每8周3300mg穴你;體重大于100kg的患者,負(fù)荷劑量3000mg泊铸, 維持劑量每8周3600mg)乓收,而eculizumab則根據(jù)說明給藥。預(yù)期的臨床終點(diǎn)是26周內(nèi)血漿乳酸脫氫酶(LDH)達(dá)正常水平的情況者侄。試驗(yàn)招募了246名患者愧棋,將在2017年12月達(dá)到終點(diǎn)兼峻。另一項(xiàng)3期臨床試驗(yàn)則旨在評(píng)估Ravulizumab對(duì)使用eculizumab治療6個(gè)月以上且病情穩(wěn)定患者的療效。Ravulizumab組的給藥方案與前一項(xiàng)臨床試驗(yàn)相同罗和,eculizumab組的患者則在第183天上給予負(fù)荷劑量的Ravulizumab神深,第197天給予維持劑量,主要終點(diǎn)是26周血漿乳酸脫氫酶(LDH)水平的改變情況功哮。試驗(yàn)招募了197名患者仅谍,試驗(yàn)將在2018年3月結(jié)束。亞力兄弟有望在2018年2季度報(bào)告這兩項(xiàng)試驗(yàn)的結(jié)果援奢,并提交BLA兼犯。此前Ravulizumab已經(jīng)獲得美國和歐洲PNH的孤兒藥認(rèn)定。與aHUS相關(guān)的單臂三期臨床試驗(yàn)NCT02949128招募了55名患者集漾,試驗(yàn)有望在2018年初結(jié)束切黔,另一項(xiàng)關(guān)于兒童aHUS的三期臨床試驗(yàn)NCT03131219也在進(jìn)行中,結(jié)束時(shí)間是2018年12月具篇。
Eptinezumab
Eptinezumab (ALD403) 是一個(gè)IgG1單抗绕娘,靶點(diǎn)為降鈣素基因相關(guān)肽(CGRP),開發(fā)適應(yīng)癥是偏頭痛栽连。2017年6月险领,Alder BioPharma宣布三期臨床 PROMISE1 試驗(yàn)(NCT02559895)達(dá)到主要和次要終點(diǎn)。納入這項(xiàng)研究的陣發(fā)性偏頭痛患者平均頭痛天數(shù)是8.6天/月秒紧,試驗(yàn)中患者分別給予eptinezumab 300mg绢陌、100mg、30mg或安慰劑熔恢,最終30mg的低劑量組未納入結(jié)果統(tǒng)計(jì)脐湾。結(jié)果顯示,1至12周觀察到患者每月頭痛次數(shù)顯著下降叙淌,300mg組每月頭痛為4.3天隶秒,100mg組為3.9天,安慰劑組為3.2天摆咽。接近三分之一的患者在第4-12周的每月頭痛天數(shù)下降75%以上媒敲,平均有五分之一的患者在1-6月內(nèi)未至少有一個(gè)月未發(fā)生頭痛。另一項(xiàng)專門針對(duì)慢性偏頭痛設(shè)計(jì)的三期臨床試驗(yàn)PROMISE2 (NCT02974153) 已招募1050名患者种功,該試驗(yàn)將在2018年上半年結(jié)束透鹊,Alder計(jì)劃在2018年2季度提交上市申請(qǐng)。
Risankizumab
Risankizumab (ABBV066, BI655066)是一種以IL-23的p19亞基為靶點(diǎn)的IgG1單抗共吞,開發(fā)適應(yīng)癥為銀屑病召期。2017年10月,艾伯維宣布以u(píng)stekinumab和adalimumab為對(duì)照的三期臨床試驗(yàn)達(dá)終點(diǎn)。在ultIMMa-1(NCT02684370)和ultIMMa-2(NCT02684357)試驗(yàn)中编漆,以u(píng)stekinumab和安慰劑為對(duì)照評(píng)估了risankizumab的有效性践桂。經(jīng)過16周的治療,兩項(xiàng)試驗(yàn)中接受risankizumab治療的患者跌蛔,達(dá)PASI90的患者比率均為75%级汹,而接受ustekinumab患者,分別為 42%和48%雌芽,安慰劑則分別只有5%和2%授艰。risankizumab治療組sPGA評(píng)分達(dá)標(biāo)率分別為88%和84%辨嗽,ustekinumab治療組分別為63%和62%世落,安慰劑組僅為8%和5%。在IMMvent研究(NCT02694523)中糟需,患者分別接受risankizumab或adalimumab治療16周屉佳,risankizumab組達(dá)PASI90的患者比例為72%,阿達(dá)木單抗組則只有47%洲押,risankizumab組sPGA達(dá)標(biāo)率為84%武花,而阿達(dá)木單抗只有60%。本品有望在2018年提交BLA杈帐,2019年上市体箕。
Satralizumab
Satralizumab (SA237) 是一種人源化IgG2單抗,靶點(diǎn)為白介素-6受體(IL-6R)挑童,開發(fā)適應(yīng)癥為視神經(jīng)脊髓炎或視神經(jīng)脊髓炎譜系疾病累铅。評(píng)估Satralizumab添加基線治療安全有效性的三期臨床試驗(yàn)NCT02028884還在進(jìn)行中,主要的治療終點(diǎn)是30個(gè)月內(nèi)的疾病首次復(fù)發(fā)時(shí)間站叼,該試驗(yàn)已招募了70名患者禽岭,預(yù)期將于2018年7月結(jié)束。另一項(xiàng)安慰劑對(duì)照的三期臨床試驗(yàn)NCT02073279也已經(jīng)完成招募普毙,主要的治療終點(diǎn)為38個(gè)月內(nèi)疾病首次復(fù)發(fā)的時(shí)間艘励,該試驗(yàn)已經(jīng)招募到98名患者,有望在2018年10月結(jié)束捍骇。此前該產(chǎn)品已經(jīng)獲得FDA和EMA關(guān)于視神經(jīng)脊髓炎譜系疾病的孤兒藥認(rèn)定唆痪,有望在2018年下半年提交上市申請(qǐng)。
Brolucizumab
Brolucizumab (RTH258) 是一種單鏈可變區(qū)片段闰收,靶點(diǎn)為血管表皮細(xì)胞生長因子A(VEGF)-A戒款,開發(fā)適應(yīng)癥為新生血管性老年性黃斑變性(nAMD)。2017年6月执寺,諾華宣布三期臨床試驗(yàn)HAWK (NCT02307682)和HARRIER (NCT02434328)達(dá)治療終點(diǎn)区孩,Brolucizumab治療組48周平均最佳矯正視力相對(duì)基線改善情況非劣于aflibercept。這兩項(xiàng)試驗(yàn)納入nAMD患者超過1800人洞惕,分別給予brolucizumab 6mg刑嚷、brolucizumab 3mg(HARRIER 不涉及)或aflibercept 2mg略裹。結(jié)果顯示Brolucizumab 6mg在兩項(xiàng)試驗(yàn)中都以顯著p值到達(dá)主要終點(diǎn)和關(guān)鍵次要終點(diǎn);Brolucizumab 3mg也在HAWK中到達(dá)這些終點(diǎn)闽巩。此外钧舌,在HAWK和HARRIER試驗(yàn)中,12周用藥一次的患者分別有57%和52%堅(jiān)持用藥到48周涎跨。Brolucizumab表現(xiàn)出良好的耐受性洼冻,總體眼睛和非眼睛不良反應(yīng)發(fā)生率都與aflibercept相當(dāng)。諾華有望在2018年完成低劑量規(guī)格的PK試驗(yàn)隅很,BLA有望在2018年下半年提交撞牢。
PRO140
PRO140 是一種人源化IgG4單抗,靶點(diǎn)為CC趨化因子受體5(CCR5)叔营,可防止HIV病毒進(jìn)入T細(xì)胞屋彪,目前開發(fā)適應(yīng)癥為艾滋病。兩項(xiàng)2/3期臨床試驗(yàn)(NCT02483078和NCT02859961)已經(jīng)在2017年10月和2017年12月完成绒尊。NCT02483078是一項(xiàng)隨機(jī)畜挥、雙盲、安慰劑對(duì)照的臨床試驗(yàn)婴谱,耐藥的HIV感染者在最佳抗病毒藥的背景治療下蟹但,添加PRO140或安慰劑治療。而NCT02859961則研究的是抗逆轉(zhuǎn)錄病毒治療后病情處于穩(wěn)定期的患者决太,換用PRO140單獨(dú)治療的有效性蓉厕。2017年10月,CytoDyn與FDA進(jìn)行會(huì)晤排貌,就提交聯(lián)合用藥BLA所需的受試人數(shù)和患者類型展開商討犬洽,F(xiàn)DA要求NCT02483078試驗(yàn)完成50例患者的研究,BLA要中提交總數(shù)300人的安全性評(píng)估投谅。目前該產(chǎn)品已經(jīng)獲得FDA快速審評(píng)通道資格纪萎,這也就意味著本品可以提交滾動(dòng)BLA申請(qǐng)。
Sacituzumab govitecan
Sacituzumab govitecan (IMMU-132) 是一種抗體偶聯(lián)物蘑劲,由人源化anti-Trop-2抗體偶聯(lián)伊立替康活性代謝物SN38而成虹限,開發(fā)適應(yīng)癥為晚期三陰乳腺癌 (TNBC)。2017年11月似魄,Immunomedics宣布該公司將在2018年一季度提交BLA彭薪,此前本品已經(jīng)獲得FDA三陰乳腺癌突破性療法認(rèn)定,支持將BLA的數(shù)據(jù)來自NCT01631552研究作姐。110例三陰乳腺癌患者接受10mg/kg的sacituzumab govitecan治療夜矗,客觀緩解率為34%,臨床受益率為46%,Kaplan-Meier(KM)中位有效期和無進(jìn)展生存期分別為7.6月和5.5月紊撕。驗(yàn)證本品對(duì)復(fù)發(fā)或難治性三陰乳腺癌療效的三期臨床試驗(yàn)ASCENT(NCT02574455)已經(jīng)招募到328名患者罢荡,入組的患者均為2種以上方案化療后進(jìn)展或最少一種方案化療并接受輔助治療后12個(gè)月內(nèi)進(jìn)展的患者。試驗(yàn)中患者分別接受sacituzumab govitecan或4個(gè)預(yù)先設(shè)定的單藥治療方案化療对扶,該試驗(yàn)已經(jīng)在進(jìn)行中区赵。
Moxetumomab pasudotox
Moxetumomab pasudotox (HA22,CAT- 8015) 是一種分子量為38kDa的重組銅綠假單胞菌外毒素的毒性部分與CD22抗體可變區(qū)片段融合的抗體偶聯(lián)物。早在2016年2月浪南,Moxetumomab pasudotox就獲得FDA多毛細(xì)胞白血病 (HCL)的孤兒藥認(rèn)定笼才。本品目前在開展一項(xiàng)復(fù)發(fā)或難治性HCL的多中心、單臂三期臨床試驗(yàn)(NCT01829711)络凿,該試驗(yàn)已經(jīng)在2017年五月達(dá)到主要終點(diǎn)骡送,阿斯利康計(jì)劃在2018年提交BLA。
Cemiplimab
Cemiplimab (REGN2810, SAR439684) 是一種人程序性死亡受體1(PD-1)單抗喷众,開發(fā)適應(yīng)癥為無法手術(shù)的或轉(zhuǎn)移性皮膚鱗狀細(xì)胞癌(CSCC)各谚,目前該適應(yīng)癥已經(jīng)獲得FDA突破性療法認(rèn)定紧憾。一期臨床試驗(yàn)NCT02383212顯示本品對(duì)局部進(jìn)展性CSCC和轉(zhuǎn)移性CSCC均有很好的療效到千,綜合客觀緩解率為46.2%。目前賽諾菲和再生元正在共同開發(fā)Cemiplimab块生,BLA有望在2018年一季度首次提交稻诚。另外一項(xiàng)以無法手術(shù)的或轉(zhuǎn)移性CSCC為研究對(duì)象,名為EMPOWER-CSCC1的二期臨床試驗(yàn)也在開展中廓蒜。除了CSCC辖狞,賽諾菲和再生元還在積極開展宮頸癌(NCT03257267)和非小細(xì)胞肺癌肺癌(NCT03088540)的三期臨床試驗(yàn),試驗(yàn)終點(diǎn)將分別在2020年5月和2021年11月達(dá)到奴妈。
Ublituximab
Ublituximab (LFB-R603, TGT-1101, TGTX-1101)是一種糖基化的嵌合型抗體孩置,靶點(diǎn)為CD20。該抗體含低含量的巖藻糖窃愿,可改善FcγRIIIa的結(jié)合率罚栏,抗體依賴的細(xì)胞介導(dǎo)的細(xì)胞毒性作用(ADCC)相比利妥昔單抗有所增強(qiáng),開發(fā)適應(yīng)癥為慢性淋巴瘤白血病 (CLL)恨递。一項(xiàng)多中心增捻、開放標(biāo)簽的三期臨床GENUINE試驗(yàn)(NCT02301156)評(píng)估了ublituximab與依魯替尼聯(lián)合用藥相對(duì)依魯替尼單獨(dú)用藥的安全有效性。該試驗(yàn)共有126名CLL患者入組溺瘩,患者每日一次給予依魯替尼420mg或依魯替尼420mg+ublituximab锥惋,結(jié)果顯示聯(lián)合用藥組客觀緩解率為78%,而依魯替尼單藥組僅為45%开伏,無進(jìn)展生存期也有所改善膀跌,風(fēng)險(xiǎn)比達(dá)0.559。另一項(xiàng)名為UNITY-CLL的三期臨床試驗(yàn)(NCT02612311)旨在評(píng)估Ublituximab聯(lián)合PI3K抑制劑TGR-1202對(duì)CLL的安全有效性,臨床試驗(yàn)以obinutuzumab+苯丁酸氮芥捅伤、ublituximab單獨(dú)用藥或TGR-1202單獨(dú)用藥為參照株婴。該試驗(yàn)已在進(jìn)行中,有望在2018年9月達(dá)到終點(diǎn)暑认。除了CLL困介,obinutuzumab聯(lián)合TGR-1202治療非霍奇金淋巴瘤的臨床研究也在開展之中。該試驗(yàn)是一項(xiàng)名為UNITY-NHL的2/3期臨床試驗(yàn) (NCT02793583)蘸际,預(yù)期在2019年5月達(dá)到終點(diǎn)座哩。除了癌癥外,obinutuzumab也在積極開發(fā)多發(fā)性硬化的治療方案粮彤,兩項(xiàng)隨機(jī)雙盲根穷、多中心三期臨床試驗(yàn)ULTIMATEI(NCT03277261)和ULTIMATEII(NCT03277248)已經(jīng)開展,用以對(duì)比obinutuzumab和特立氟胺在復(fù)發(fā)性多發(fā)性硬化上的安全有效性蓝漏。這兩項(xiàng)試驗(yàn)達(dá)到終點(diǎn)的預(yù)期時(shí)間是2021年3月诽怨。
處在臨床開發(fā)晚期的單抗
除了以上提到的產(chǎn)品外,還有20個(gè)單抗產(chǎn)品處在臨床后期吭匀,分別是sirukumab食云,lampalizumab,roledumab螺城,emapalumab痒池,fasinumab,tanezumab躬伐,etrolizumab凉陌,birtamimab,gantenerumab吵墅,anifrolumab埠浩,tremelimumab,isatuximab公遭,BCD-100屠伴,carotuximab,camrelizumab酵熙,IBI308轧简,glembatumumab vedotin,mirvetuximab soravtansine匾二,oportuzumab monatox哮独,L19IL2/L19TNF。其中sirukumab已經(jīng)在2017年9月遭到FDA拒絕察藐,F(xiàn)DA要求強(qiáng)生補(bǔ)充額外的臨床數(shù)據(jù)證明sirukumab的安全性皮璧,其他19個(gè)產(chǎn)品大部分還沒有關(guān)鍵性臨床試驗(yàn)數(shù)據(jù)舟扎,而但這些數(shù)據(jù)有望在2018下半年或2019年獲得,預(yù)期上市時(shí)間是2019年至2020年悴务,我們暫且把它們驚喜留到明年介紹睹限。
毫無疑問,單抗的開發(fā)正在提速讯檐,據(jù)估計(jì)至2020年獲批的單抗產(chǎn)品總數(shù)將超過100個(gè)羡疗,同時(shí)單抗的市場也將一路高歌,2020年單抗藥物的總市場規(guī)模有望觸及1300億美元别洪,2018年叨恨,單抗們拭目以待!
Lanadelumab (SHP643熙侍,DX-2930)是一種人IgG1單抗,可通過抑制血漿激肽釋放酶而阻止緩激肽的生產(chǎn)履磨。Lanadelumab在三期臨床開展的適應(yīng)癥為遺傳性血管性水腫(HAE)蛉抓,遺傳血管性水腫是一種以身體受到外界侵害后引發(fā)組織水腫為特征的罕見病。Lanadelumab已經(jīng)獲得美國和歐洲授予的HAE孤兒藥資格和FDA HAE突破性療法認(rèn)定剃诅。2017年5月巷送,夏爾報(bào)告了一項(xiàng)為期26周的三期臨床HELP試驗(yàn)(NCT02586805)數(shù)據(jù),該試驗(yàn)就lanadelumab的安全性和阻止 I 型和II型HAE患者急性血管水腫發(fā)生率的療效進(jìn)行了評(píng)估矛辕。試驗(yàn)中笑跛,49名患者每二周一次給予lanadelumab 300mg,或每四周一次給予lanadelumab 300mg聊品,或每四周一次給予lanadelumab 150mg或安慰劑飞蹂。結(jié)果顯示,每二周一次給予lanadelumab 300mg翻屈,每四周一次給予lanadelumab 300mg和每四周一次給予lanadelumab 150mg的患者陈哑,血管水腫發(fā)生率相比安慰劑分別下降87%,73%和76%奋肄,試驗(yàn)達(dá)到既定的主要終點(diǎn)和次要終點(diǎn)轿南。另一項(xiàng)開放標(biāo)簽的三期臨床長期安全有效性研究 (NCT02741596)用以評(píng)估lanadelumab阻止 I 型和II型HAE患者急性血管水腫發(fā)生的效率,治療終點(diǎn)將在2018年2月到達(dá)量伏。本品的上市申請(qǐng)將在2018年初提交到FDA和EMA兴氧。
Crizanlizumab
Crizanlizumab (SEG101) 是一種人源化單抗,靶點(diǎn)為血小板選擇蛋白畴贵,也就是眾所周知的CD62厦冤,研究的適應(yīng)癥為鐮狀細(xì)胞疼痛危象 (SCPC)。鐮狀細(xì)胞危象臨床表現(xiàn)為慢性溶血性貧血幅秉,易感染和再發(fā)性疼痛危象以致慢性局部缺血導(dǎo)致器官組織局部損壞奔豫。在安慰劑對(duì)照的二期SUSTAIN試驗(yàn)(NCT01895361)中,198名16到65歲的患者渠跷,以5mg/kg的劑量袄洁,每四周一次給予crizanlizumab,連續(xù)治療50周收罢,SCPC年化率中位值相對(duì)安慰劑下降45.3%(1.63 vs 2.98)晤泌,用藥后首次發(fā)生SCPC的時(shí)間相比安慰劑延長2.9倍(中位時(shí)間分別為4.07月和1.38月),第二次發(fā)生SCPC的時(shí)間相比安慰劑延長2.0倍(中位時(shí)間分別為10.32月和5.09月)耕姊。此前桶唐,crizanlizumab在美國和歐洲均已獲得SCPC孤兒藥認(rèn)定,如果PK/PD數(shù)據(jù)與最終的生產(chǎn)工藝生產(chǎn)的產(chǎn)品一致茉兰,諾華將在2018年提交BLA尤泽。
Ravulizumab
Ravulizumab (ALXN1210) 是一種人源化,以補(bǔ)體5(C5)為靶點(diǎn)的單抗规脸,是eculizumab的下一代坯约,目前處于注冊前期階段。其開展的臨床試驗(yàn)包括2項(xiàng)與陣發(fā)性睡眠性血紅蛋白尿癥(PNH)相關(guān)的三期臨床試驗(yàn)和2項(xiàng)與非典型溶血尿毒綜合征 (aHUS)相關(guān)的三期臨床試驗(yàn)莫鸭。這2項(xiàng)(PNH)三期臨床試驗(yàn)NCT02946463 和NCT03056040是基于一項(xiàng)1/2期臨床試驗(yàn)的結(jié)果闹丐。未經(jīng)補(bǔ)體抑制劑治療的患者使用Ravulizumab后血漿乳酸脫氫酶(LDH)水平快速并持續(xù)下降,F(xiàn)ACIT疲勞量表得分顯著改善被因。3期臨床試驗(yàn)NCT02946463旨在評(píng)估Ravulizumab相對(duì)eculizumab治療未經(jīng)補(bǔ)體抑制劑治療的成年P(guān)NH患者的安全有效性妇智。該試驗(yàn)中,患者基于體重在第一天給予一個(gè)負(fù)荷劑量氏身,第15天給予維持劑量( 40至60kg體重:負(fù)荷劑量2400mg巍棱, 維持劑量每8周3000mg;60至100kg體重: 負(fù)荷劑量2700mg爱亡, 維持劑量每8周3300mg穴你;體重大于100kg的患者,負(fù)荷劑量3000mg泊铸, 維持劑量每8周3600mg)乓收,而eculizumab則根據(jù)說明給藥。預(yù)期的臨床終點(diǎn)是26周內(nèi)血漿乳酸脫氫酶(LDH)達(dá)正常水平的情況者侄。試驗(yàn)招募了246名患者愧棋,將在2017年12月達(dá)到終點(diǎn)兼峻。另一項(xiàng)3期臨床試驗(yàn)則旨在評(píng)估Ravulizumab對(duì)使用eculizumab治療6個(gè)月以上且病情穩(wěn)定患者的療效。Ravulizumab組的給藥方案與前一項(xiàng)臨床試驗(yàn)相同罗和,eculizumab組的患者則在第183天上給予負(fù)荷劑量的Ravulizumab神深,第197天給予維持劑量,主要終點(diǎn)是26周血漿乳酸脫氫酶(LDH)水平的改變情況功哮。試驗(yàn)招募了197名患者仅谍,試驗(yàn)將在2018年3月結(jié)束。亞力兄弟有望在2018年2季度報(bào)告這兩項(xiàng)試驗(yàn)的結(jié)果援奢,并提交BLA兼犯。此前Ravulizumab已經(jīng)獲得美國和歐洲PNH的孤兒藥認(rèn)定。與aHUS相關(guān)的單臂三期臨床試驗(yàn)NCT02949128招募了55名患者集漾,試驗(yàn)有望在2018年初結(jié)束切黔,另一項(xiàng)關(guān)于兒童aHUS的三期臨床試驗(yàn)NCT03131219也在進(jìn)行中,結(jié)束時(shí)間是2018年12月具篇。
Eptinezumab
Eptinezumab (ALD403) 是一個(gè)IgG1單抗绕娘,靶點(diǎn)為降鈣素基因相關(guān)肽(CGRP),開發(fā)適應(yīng)癥是偏頭痛栽连。2017年6月险领,Alder BioPharma宣布三期臨床 PROMISE1 試驗(yàn)(NCT02559895)達(dá)到主要和次要終點(diǎn)。納入這項(xiàng)研究的陣發(fā)性偏頭痛患者平均頭痛天數(shù)是8.6天/月秒紧,試驗(yàn)中患者分別給予eptinezumab 300mg绢陌、100mg、30mg或安慰劑熔恢,最終30mg的低劑量組未納入結(jié)果統(tǒng)計(jì)脐湾。結(jié)果顯示,1至12周觀察到患者每月頭痛次數(shù)顯著下降叙淌,300mg組每月頭痛為4.3天隶秒,100mg組為3.9天,安慰劑組為3.2天摆咽。接近三分之一的患者在第4-12周的每月頭痛天數(shù)下降75%以上媒敲,平均有五分之一的患者在1-6月內(nèi)未至少有一個(gè)月未發(fā)生頭痛。另一項(xiàng)專門針對(duì)慢性偏頭痛設(shè)計(jì)的三期臨床試驗(yàn)PROMISE2 (NCT02974153) 已招募1050名患者种功,該試驗(yàn)將在2018年上半年結(jié)束透鹊,Alder計(jì)劃在2018年2季度提交上市申請(qǐng)。
Risankizumab
Risankizumab (ABBV066, BI655066)是一種以IL-23的p19亞基為靶點(diǎn)的IgG1單抗共吞,開發(fā)適應(yīng)癥為銀屑病召期。2017年10月,艾伯維宣布以u(píng)stekinumab和adalimumab為對(duì)照的三期臨床試驗(yàn)達(dá)終點(diǎn)。在ultIMMa-1(NCT02684370)和ultIMMa-2(NCT02684357)試驗(yàn)中编漆,以u(píng)stekinumab和安慰劑為對(duì)照評(píng)估了risankizumab的有效性践桂。經(jīng)過16周的治療,兩項(xiàng)試驗(yàn)中接受risankizumab治療的患者跌蛔,達(dá)PASI90的患者比率均為75%级汹,而接受ustekinumab患者,分別為 42%和48%雌芽,安慰劑則分別只有5%和2%授艰。risankizumab治療組sPGA評(píng)分達(dá)標(biāo)率分別為88%和84%辨嗽,ustekinumab治療組分別為63%和62%世落,安慰劑組僅為8%和5%。在IMMvent研究(NCT02694523)中糟需,患者分別接受risankizumab或adalimumab治療16周屉佳,risankizumab組達(dá)PASI90的患者比例為72%,阿達(dá)木單抗組則只有47%洲押,risankizumab組sPGA達(dá)標(biāo)率為84%武花,而阿達(dá)木單抗只有60%。本品有望在2018年提交BLA杈帐,2019年上市体箕。
Satralizumab
Satralizumab (SA237) 是一種人源化IgG2單抗,靶點(diǎn)為白介素-6受體(IL-6R)挑童,開發(fā)適應(yīng)癥為視神經(jīng)脊髓炎或視神經(jīng)脊髓炎譜系疾病累铅。評(píng)估Satralizumab添加基線治療安全有效性的三期臨床試驗(yàn)NCT02028884還在進(jìn)行中,主要的治療終點(diǎn)是30個(gè)月內(nèi)的疾病首次復(fù)發(fā)時(shí)間站叼,該試驗(yàn)已招募了70名患者禽岭,預(yù)期將于2018年7月結(jié)束。另一項(xiàng)安慰劑對(duì)照的三期臨床試驗(yàn)NCT02073279也已經(jīng)完成招募普毙,主要的治療終點(diǎn)為38個(gè)月內(nèi)疾病首次復(fù)發(fā)的時(shí)間艘励,該試驗(yàn)已經(jīng)招募到98名患者,有望在2018年10月結(jié)束捍骇。此前該產(chǎn)品已經(jīng)獲得FDA和EMA關(guān)于視神經(jīng)脊髓炎譜系疾病的孤兒藥認(rèn)定唆痪,有望在2018年下半年提交上市申請(qǐng)。
Brolucizumab
Brolucizumab (RTH258) 是一種單鏈可變區(qū)片段闰收,靶點(diǎn)為血管表皮細(xì)胞生長因子A(VEGF)-A戒款,開發(fā)適應(yīng)癥為新生血管性老年性黃斑變性(nAMD)。2017年6月执寺,諾華宣布三期臨床試驗(yàn)HAWK (NCT02307682)和HARRIER (NCT02434328)達(dá)治療終點(diǎn)区孩,Brolucizumab治療組48周平均最佳矯正視力相對(duì)基線改善情況非劣于aflibercept。這兩項(xiàng)試驗(yàn)納入nAMD患者超過1800人洞惕,分別給予brolucizumab 6mg刑嚷、brolucizumab 3mg(HARRIER 不涉及)或aflibercept 2mg略裹。結(jié)果顯示Brolucizumab 6mg在兩項(xiàng)試驗(yàn)中都以顯著p值到達(dá)主要終點(diǎn)和關(guān)鍵次要終點(diǎn);Brolucizumab 3mg也在HAWK中到達(dá)這些終點(diǎn)闽巩。此外钧舌,在HAWK和HARRIER試驗(yàn)中,12周用藥一次的患者分別有57%和52%堅(jiān)持用藥到48周涎跨。Brolucizumab表現(xiàn)出良好的耐受性洼冻,總體眼睛和非眼睛不良反應(yīng)發(fā)生率都與aflibercept相當(dāng)。諾華有望在2018年完成低劑量規(guī)格的PK試驗(yàn)隅很,BLA有望在2018年下半年提交撞牢。
PRO140
PRO140 是一種人源化IgG4單抗,靶點(diǎn)為CC趨化因子受體5(CCR5)叔营,可防止HIV病毒進(jìn)入T細(xì)胞屋彪,目前開發(fā)適應(yīng)癥為艾滋病。兩項(xiàng)2/3期臨床試驗(yàn)(NCT02483078和NCT02859961)已經(jīng)在2017年10月和2017年12月完成绒尊。NCT02483078是一項(xiàng)隨機(jī)畜挥、雙盲、安慰劑對(duì)照的臨床試驗(yàn)婴谱,耐藥的HIV感染者在最佳抗病毒藥的背景治療下蟹但,添加PRO140或安慰劑治療。而NCT02859961則研究的是抗逆轉(zhuǎn)錄病毒治療后病情處于穩(wěn)定期的患者决太,換用PRO140單獨(dú)治療的有效性蓉厕。2017年10月,CytoDyn與FDA進(jìn)行會(huì)晤排貌,就提交聯(lián)合用藥BLA所需的受試人數(shù)和患者類型展開商討犬洽,F(xiàn)DA要求NCT02483078試驗(yàn)完成50例患者的研究,BLA要中提交總數(shù)300人的安全性評(píng)估投谅。目前該產(chǎn)品已經(jīng)獲得FDA快速審評(píng)通道資格纪萎,這也就意味著本品可以提交滾動(dòng)BLA申請(qǐng)。
Sacituzumab govitecan
Sacituzumab govitecan (IMMU-132) 是一種抗體偶聯(lián)物蘑劲,由人源化anti-Trop-2抗體偶聯(lián)伊立替康活性代謝物SN38而成虹限,開發(fā)適應(yīng)癥為晚期三陰乳腺癌 (TNBC)。2017年11月似魄,Immunomedics宣布該公司將在2018年一季度提交BLA彭薪,此前本品已經(jīng)獲得FDA三陰乳腺癌突破性療法認(rèn)定,支持將BLA的數(shù)據(jù)來自NCT01631552研究作姐。110例三陰乳腺癌患者接受10mg/kg的sacituzumab govitecan治療夜矗,客觀緩解率為34%,臨床受益率為46%,Kaplan-Meier(KM)中位有效期和無進(jìn)展生存期分別為7.6月和5.5月紊撕。驗(yàn)證本品對(duì)復(fù)發(fā)或難治性三陰乳腺癌療效的三期臨床試驗(yàn)ASCENT(NCT02574455)已經(jīng)招募到328名患者罢荡,入組的患者均為2種以上方案化療后進(jìn)展或最少一種方案化療并接受輔助治療后12個(gè)月內(nèi)進(jìn)展的患者。試驗(yàn)中患者分別接受sacituzumab govitecan或4個(gè)預(yù)先設(shè)定的單藥治療方案化療对扶,該試驗(yàn)已經(jīng)在進(jìn)行中区赵。
Moxetumomab pasudotox
Moxetumomab pasudotox (HA22,CAT- 8015) 是一種分子量為38kDa的重組銅綠假單胞菌外毒素的毒性部分與CD22抗體可變區(qū)片段融合的抗體偶聯(lián)物。早在2016年2月浪南,Moxetumomab pasudotox就獲得FDA多毛細(xì)胞白血病 (HCL)的孤兒藥認(rèn)定笼才。本品目前在開展一項(xiàng)復(fù)發(fā)或難治性HCL的多中心、單臂三期臨床試驗(yàn)(NCT01829711)络凿,該試驗(yàn)已經(jīng)在2017年五月達(dá)到主要終點(diǎn)骡送,阿斯利康計(jì)劃在2018年提交BLA。
Cemiplimab
Cemiplimab (REGN2810, SAR439684) 是一種人程序性死亡受體1(PD-1)單抗喷众,開發(fā)適應(yīng)癥為無法手術(shù)的或轉(zhuǎn)移性皮膚鱗狀細(xì)胞癌(CSCC)各谚,目前該適應(yīng)癥已經(jīng)獲得FDA突破性療法認(rèn)定紧憾。一期臨床試驗(yàn)NCT02383212顯示本品對(duì)局部進(jìn)展性CSCC和轉(zhuǎn)移性CSCC均有很好的療效到千,綜合客觀緩解率為46.2%。目前賽諾菲和再生元正在共同開發(fā)Cemiplimab块生,BLA有望在2018年一季度首次提交稻诚。另外一項(xiàng)以無法手術(shù)的或轉(zhuǎn)移性CSCC為研究對(duì)象,名為EMPOWER-CSCC1的二期臨床試驗(yàn)也在開展中廓蒜。除了CSCC辖狞,賽諾菲和再生元還在積極開展宮頸癌(NCT03257267)和非小細(xì)胞肺癌肺癌(NCT03088540)的三期臨床試驗(yàn),試驗(yàn)終點(diǎn)將分別在2020年5月和2021年11月達(dá)到奴妈。
Ublituximab
Ublituximab (LFB-R603, TGT-1101, TGTX-1101)是一種糖基化的嵌合型抗體孩置,靶點(diǎn)為CD20。該抗體含低含量的巖藻糖窃愿,可改善FcγRIIIa的結(jié)合率罚栏,抗體依賴的細(xì)胞介導(dǎo)的細(xì)胞毒性作用(ADCC)相比利妥昔單抗有所增強(qiáng),開發(fā)適應(yīng)癥為慢性淋巴瘤白血病 (CLL)恨递。一項(xiàng)多中心增捻、開放標(biāo)簽的三期臨床GENUINE試驗(yàn)(NCT02301156)評(píng)估了ublituximab與依魯替尼聯(lián)合用藥相對(duì)依魯替尼單獨(dú)用藥的安全有效性。該試驗(yàn)共有126名CLL患者入組溺瘩,患者每日一次給予依魯替尼420mg或依魯替尼420mg+ublituximab锥惋,結(jié)果顯示聯(lián)合用藥組客觀緩解率為78%,而依魯替尼單藥組僅為45%开伏,無進(jìn)展生存期也有所改善膀跌,風(fēng)險(xiǎn)比達(dá)0.559。另一項(xiàng)名為UNITY-CLL的三期臨床試驗(yàn)(NCT02612311)旨在評(píng)估Ublituximab聯(lián)合PI3K抑制劑TGR-1202對(duì)CLL的安全有效性,臨床試驗(yàn)以obinutuzumab+苯丁酸氮芥捅伤、ublituximab單獨(dú)用藥或TGR-1202單獨(dú)用藥為參照株婴。該試驗(yàn)已在進(jìn)行中,有望在2018年9月達(dá)到終點(diǎn)暑认。除了CLL困介,obinutuzumab聯(lián)合TGR-1202治療非霍奇金淋巴瘤的臨床研究也在開展之中。該試驗(yàn)是一項(xiàng)名為UNITY-NHL的2/3期臨床試驗(yàn) (NCT02793583)蘸际,預(yù)期在2019年5月達(dá)到終點(diǎn)座哩。除了癌癥外,obinutuzumab也在積極開發(fā)多發(fā)性硬化的治療方案粮彤,兩項(xiàng)隨機(jī)雙盲根穷、多中心三期臨床試驗(yàn)ULTIMATEI(NCT03277261)和ULTIMATEII(NCT03277248)已經(jīng)開展,用以對(duì)比obinutuzumab和特立氟胺在復(fù)發(fā)性多發(fā)性硬化上的安全有效性蓝漏。這兩項(xiàng)試驗(yàn)達(dá)到終點(diǎn)的預(yù)期時(shí)間是2021年3月诽怨。
處在臨床開發(fā)晚期的單抗
除了以上提到的產(chǎn)品外,還有20個(gè)單抗產(chǎn)品處在臨床后期吭匀,分別是sirukumab食云,lampalizumab,roledumab螺城,emapalumab痒池,fasinumab,tanezumab躬伐,etrolizumab凉陌,birtamimab,gantenerumab吵墅,anifrolumab埠浩,tremelimumab,isatuximab公遭,BCD-100屠伴,carotuximab,camrelizumab酵熙,IBI308轧简,glembatumumab vedotin,mirvetuximab soravtansine匾二,oportuzumab monatox哮独,L19IL2/L19TNF。其中sirukumab已經(jīng)在2017年9月遭到FDA拒絕察藐,F(xiàn)DA要求強(qiáng)生補(bǔ)充額外的臨床數(shù)據(jù)證明sirukumab的安全性皮璧,其他19個(gè)產(chǎn)品大部分還沒有關(guān)鍵性臨床試驗(yàn)數(shù)據(jù)舟扎,而但這些數(shù)據(jù)有望在2018下半年或2019年獲得,預(yù)期上市時(shí)間是2019年至2020年悴务,我們暫且把它們驚喜留到明年介紹睹限。
毫無疑問,單抗的開發(fā)正在提速讯檐,據(jù)估計(jì)至2020年獲批的單抗產(chǎn)品總數(shù)將超過100個(gè)羡疗,同時(shí)單抗的市場也將一路高歌,2020年單抗藥物的總市場規(guī)模有望觸及1300億美元别洪,2018年叨恨,單抗們拭目以待!
處在臨床末期的單抗藥物


聲明:本文的內(nèi)容大量參考了Antibodies to watch in 2018一文敏栽,但本文不是翻譯文章去弹,筆者在原文的基礎(chǔ)上進(jìn)行漢化,信息進(jìn)一步補(bǔ)充或刪減瓦轧,加入了市場相關(guān)的內(nèi)容和作者的觀點(diǎn)毛溅,因此本文是唯一的。此外够堆,藥事縱橫刊發(fā)本文僅用于學(xué)習(xí)和交流关灰,轉(zhuǎn)載此文務(wù)必注明作者和來源,否則一律視為惡意侵權(quán)舰搜,侵權(quán)必究芬过。對(duì)于文章觀點(diǎn)產(chǎn)生異議的朋友胞仅,可參考英文原文蚪桐。地址:
參考文獻(xiàn):Hélène Kaplon, Janice M. Reichert. Antibodies to watch in 2018[EB/OL].(2018-01-04)[2018-01-09] :http://www.antibodysociety.org/author/janreichert/

參考文獻(xiàn):Hélène Kaplon, Janice M. Reichert. Antibodies to watch in 2018[EB/OL].(2018-01-04)[2018-01-09] :http://www.antibodysociety.org/author/janreichert/




